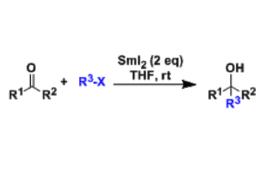
反應研究歷程
上世紀70年代末,H. Kagan系統地的研究了二價鑭系金屬碘化物的還原特性,並在這一研究的基礎上,發現在兩倍當量的二碘化釤存在下溴代烷,碘代烷或TsO烷與醛酮反應可以生成相應的醇。最初的反應條件是以四氫呋喃為溶劑室溫下反應24小時或回流幾小時。Kagan也發現在反應中加入催化量的氯化鐵可以明顯地減少反應時間,而這一方法在後來被G.A. Molander進一步的研究發展。在1984年G.A.Molander第一次報導了在分子內發生的此反應,ω-碘代酯在二碘化釤和催化量的三價鐵鹽的存在下發生分子內的醯基取代反應,並進一步發生此反應生成複合多環脂烴。現在此類反應被統稱為Kagan-Molander二碘化釤介導偶聯。這個反應常用作分子內成環。酯和兩分子的鹵代烷烴反應生成叔醇。
此反應可以由下面兩種方式進行:1)鹵代烴先與兩個當量的二碘化釤反應生成有機釤試劑,然後再加入酮(釤格氏反應);2)在酮存在下,二碘化釤和鹵代烴反應(釤Barbier反應)。最常用的製備二碘化釤的方法是研磨很細的釤金屬在四氫呋喃中與二碘甲烷,二碘乙烷或碘反應。
二碘化釤是單電子還原劑,它可以還原鹵代烴和羰基化合物。此反應的速率與反應底物的特性和反應條件有關。在釤格氏進程中,先生成有機釤中間體。而在釤Barbier進程中,機理仍然不明。
反應機理
反應體系中生成的有機釤活性中間體作為親和試劑作用。
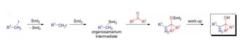 反應機理
反應機理反應特點
1)反應一般以四氫呋喃為溶劑,需要兩倍當量的二碘化釤和一些金屬催化劑;
2)有些情況下,四氫吡喃,烷基腈和苯也可以作為溶劑;
3)在標準反應條件下,烷基溴代和碘代物可以發生反應,氯代烷不發生反應;
4)有些報導中在可見光光照下氯代物可以發生反應;
5)反應底物的範圍很廣:伯鹵代物,仲鹵代物,烯丙基鹵代物和苄基鹵代物,碘代炔烴,α-雜取代鹵代烷和α-鹵代羰基化合物(samarium Reformatsky reaction);
6)芳基,乙烯基和叔鹵代物不能發生反應,它們在被還原為自由基階段後,不能被二碘化釤進一步還原,而是在四氫呋喃上得到一個氫原子;
7)有報導芳基氯代物和酮可以在苯中反應(苯上不能拔氫)。
在多數情況下,在四氫呋喃中此反應相對較慢,通常要加入一些共溶劑或催化劑。最常用的共溶劑是HMPA,它可以極大的提高二碘化釤的還原能力(E°(Sm(II)/Sm(III) in THF) =-1.33V;E°(Sm(II)/Sm(III)/4 equiv HMPA in THF) = -2.05V)。有時也會加入DMPU。許多傳統的金屬鹽都是此反應的有效催化劑:三價鐵鹽,一價和二價銅鹽,二價鎳鹽,三氯化釩,氯化銀,二溴化鈷,四氯化鋯和CpZrCl。
反應舉例
(1)Vinigrol的合成研究
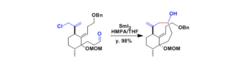 Vinigrol的合成研究
Vinigrol的合成研究(2)Upial的合成
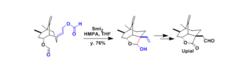 Upial的合成
Upial的合成(3)sarcodonin G的合成
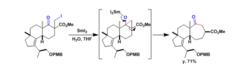 sarcodonin G的合成
sarcodonin G的合成