簡介
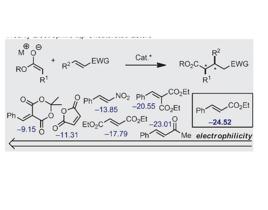
α,β-不飽和酯參與Michael加成反應的研究至今已有一百多年的歷史,然而其不對稱催化過程仍然面臨著挑戰。Herbert Mayr等人對一系列的Michael加成受體進行了系統的定量研究,數據表明,相比於其他Michael加成受體,α,β-不飽和酯的親電活性較低。
 Mukaiyama-Michael偶聯反應
Mukaiyama-Michael偶聯反應不對稱Mukaiyama-Michael偶聯反應
環狀N-磺醯基亞胺酯和烯醇矽醚的不對稱Mukaiyama-Michael偶聯反應。
底物的合成
(1)環狀N-磺醯基亞胺酯類化合物的製備方法
由不同取代的苯磺醯氯和叔丁胺反應製備N-叔丁基苯磺醯胺,在丁基鋰的作用下使鄰位發生鋰金屬化,與草酸酯發生加成反應,得到縮醛胺中間產物,最後在甲酸條件下脫叔丁醇得到相應的環狀N-磺醯基亞胺醋。
(2)烯醇矽醚的製備方法
不同取代的苯乙酮或苯丙酮在雙三甲基矽基胺基鋰的作用下,脫去a-質子,三甲基氯矽烷淬滅反應得到芳基取代的烯醇矽醚。此方法也適用於製備環己酮或1-正庚酮衍生的烯醇矽醚。
(3)反應過程
 圖2 不對稱加成反應過程
圖2 不對稱加成反應過程本部分工作主要研究了芳基酮衍生的烯醇矽醚和環狀N-磺醯基亞胺酯的不對稱Mukaiyama-Mannich加成反應,使用高氯酸鎳一雙嚷哇琳手性絡合物作為催化劑,以優異的收率(93-98%的收率)和對映選擇性(84-99%ee)得到系列不同取代的含手性季碳中心的苯並磺內醯胺類化合物,
該反應具有以下幾個優點:反應條件溫和((0℃或室溫條件下),催化劑廉價易得且用量小(大部分情況下套用2 mol%),底物普適性高(電子效應和位置效應對催化結果影響不明顯),可以進一步拓展此催化體系的套用範圍至雙烯基烯醇矽醚或者有空間位阻的烯醇矽醚,如a-取代苯乙酮衍生的烯醇矽醚和N-磺醯基亞胺酯的Mukaiyama-Mannich加成反應,再如,雙烯基矽醚參與的vinylogous Mukaiyama-Mannich加成反應,均取得優異的收率和優良的立體選擇性。
此外,Mannich產物經氧化胺化反應可衍生為對映選擇性保持的苯並磺內酞胺並叮咤環類化合物;還可以經分子內Ulltnann反應構建苯並磺醯胺並二氫喹諾酮的全新骨架。
該研究工作是首例利用手性路易斯酸催化N-磺醯基亞胺酯的Mukaiyama-Mannich加成的策略,實現高光學活性的含有手性季碳中心的3-位芳基酮取代的苯並磺內醯胺類化合物的製備方法。該合成策略為活性藥物分子的開發奠定了方法學基礎。