靶敏感脂質體定義
這時,靶敏感脂質體可能更有效,釋放的藥物通過跨膜轉運進入靶細胞內。
1 實現靶敏感的方法
見圖1。
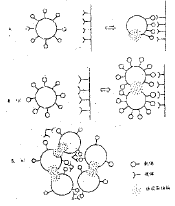
圖1 靶敏感脂質體去穩定的兩種不同機制
靶敏感脂質體在靶部位去穩定的兩種可能的機制為:①脂質體與一個多價靶結合後,配體側向運動,在脂質體與靶的接觸區聚集,造成脂質體表面上的配體由平均分布變為不平均分配,故而在脂質體膜上形成了非雙層結構,引起內容物泄露,即“contact capping”效應;②結合於同一靶的脂質體,或與多個兩價抗體結合的脂質體,相鄰脂質體之間緊密接觸,在接觸區形成非雙層結構,引起內容物泄露。
2 磷脂分子的多形性
兩親性磷脂分子分散於水中時,由於疏水效應而自動聚集,形成各種各樣的相,不同動態分子形態(dynamic molecular shape)的脂質有不同的優勢相(phase preference)。
磷脂醯乙醇胺(phosphatidylethanol-amines, PE)頭部小,而碳氫鏈所占面積比較大,呈正相的圓錐形,因而容易形成六角相(HⅡ相);並且PE的氨基與相鄰PE分子的磷脂鍵形成分子間氫鍵,降低了PE分子的水化能力,進一步有利於HⅡ相的形成。
PE的DSC圖譜見圖2。由圖2看出,PE從雙層結構向六角相轉變(Lα→HⅡ)時只發生很小的焓變,而結構發生了巨大的重組,說明HⅡ中的醯基鏈與雙層中的醯基鏈的混亂程度並無十分顯著的差異。雙層相與六角相之間相互轉換的能壘很低,這就暗示了PE作為靶敏感脂質體主要脂質的可行性。

加熱和冷卻速率為5℃/min,雙箭頭表示Lα→HⅡ的轉變溫度
3 影響因素
3.1 有效的頭部面積 頭部面積增加有利於形成雙層結構。例如,二油醯磷脂醯膽鹼(dioleoyl-phosphatidylcholine, DOPC)易於形成雙層結構,而二油醯磷脂醯乙醇胺(dioleoyl-phosphatidylethanolamine, DOPE)易於形成六角相。
3.2 靜電斥力、氫鍵 由鹽、二價陽離子、pH降低所引起的頭部離子化,均有利於雙層結構的形成。而分子間氫鍵則有利於六角相的形成。
3.3 水化程度 去水化有利於HⅡ相。
3.4 碳氫鏈長度及飽和度 降低碳氫鏈長度及飽和度有利於形成HⅡ相。如二硬脂醯磷脂醯乙醇胺(DSPE) 由雙層結構轉變為六角相的相轉變溫度(TH)為101℃;DOPE有一順式不飽和雙鍵,TH為10℃。
3.5 溫度 升高溫度,碳氫鏈混亂程度增加,HⅡ相形成的可能性增加。
3.6 雙層結構穩定劑 帶電荷的或高度可水化的兩親性分子均可作為雙層結構的穩定劑。磷脂醯膽鹼(phosphatidylcholine, PC)、磷脂醯絲胺酸(phosphatidylserine, PS)、磷脂醯肌醇(phosphatidylinositol, PI)、磷脂醯甘油(phosphatidylglycerol, PG)在含量高於20mol%時,均可穩定PE雙層。這主要是由於它們降低了PE分子間的氫鍵,同時增加了界面水化度。寡糖通過增加DOPE雙層界面水化度、負電排斥及空間位阻防止雙層之間的接觸而穩定雙層結構。
4 靶敏感脂質體的發展
4.1 衍生化的抗體既作為雙層結構的穩定劑,又作為尋靶的配體 早期研究將抗簡單皰疹病毒HSV糖蛋白gD的單抗用棕櫚酸酯化(PIGG)後,穩定脂質體所需的最小濃度為pIgG: PE = 2.5×10-4 (mol/mol)。研究發現,抗體衍生化主要發生在Fc段(可結晶段,fragment crystallizable),而Fab段(抗原結合段,fragment of antigen binding)暴露在外,不但能被gD抗原識別結合,而且易於水化,從而穩定PE雙層。pIgG在雙層中能自由擴散,當抗原-抗體發生反應時,pIgG集中於抗原-脂質體的接觸區,從而引起脂質體中的PE富集區去穩定,釋放內容物,即所謂的“contact capping”效應。
另外,有人用共振能量轉換技術研究發現,脂質體去穩定的程度和表觀速率強烈地依賴於脂質體的濃度。當脂質體濃度低時(0.1μmol/L),一個病毒子只去穩定1~2個脂質體;而高濃度時(1~10μmol/L),一個病毒子可結合34~104個脂質體,此時,一個病毒子上結合的脂質體雙層之間相互接觸,從而誘導HⅡ相的形成。
這種早期的靶敏感脂質體穩定性較差,並且不是所有的單抗都有雙層結構的穩定作用。
4.2 醯基化的抗體只作為尋靶配體,帶電荷的或可水化的雙親性分子作為雙層結構穩定劑 研究發現,組成為80%DOPE,20%二油醯磷脂酸(dioleoyl phosphatidic acid, DOPA),0.06mol%磷脂化抗體的靶敏感脂質體可穩定長達30d,而免疫脂質體的特異性仍然保留,也就是只有HSV-1病毒子或病毒感染的細胞能誘導脂質體溶解。DOPA帶負電荷,靜電排斥而阻止雙層之間的接觸,因此有很強的穩定作用。
這種改進的靶敏感脂質體的去穩定機制研究表明,免疫脂質體與靶部位的多價結合是至關重要的,而不一定需要contact capping效應,因為脂質體中包含有足夠量的強效的雙層結構穩定劑DOPA。因此脂質體溶解很可能是結合於同一靶的相鄰脂質體緊密接觸的結果,並且有實驗結果證實了這一假設。首先, HSV-1病毒子或含有它的抗原決定簇的囊泡所引起免疫脂質體的溶解常常伴隨著廣泛的的脂質體的聚集;游離抗體或游離抗原決定簇抑制脂質體聚集後強烈抑制脂質體的溶解。其次,免疫脂質體溶解的表觀活化能很大(5.46×104J/mol),這與純PE的水化排斥力4.2×104~4.2×105J/mol相一致,說明脂質體去穩定的限制步驟是結合於同一靶的相鄰脂質體克服水化排斥力,而不是由雙層結構轉變為六角相結構。
5 套用
5.1 藥物傳輸 用包裹阿糖胞苷(ara-C)或阿昔洛韋(Acyclovir,ACV)的靶敏感脂質體處理HSV感染的L929細胞,發現游離ACV的ED50為1.1μg/ml,當用靶敏感脂質體包裹後,ED50降為125ng/ml,並且非特異性細胞毒性降低了2個數量級;ara-C包入靶敏感脂質體後ED50約為1.8ng/ml,比游離藥物低1000倍,而細胞毒性降低4個數量級。但是用PC代替PE後,ara-C的抗病毒活性降低了1.5個數量級,說明了脂質體中PE成分的重要性。
5.2 免疫測定 靶敏感脂質體包裹鈣黃綠素(calcein)或鹼性磷酸酶後與HSV孵育,引起脂質體去穩定、溶解,calcein螢光增強,鹼性磷酸酶酶活性增加。用calcein螢光或酶活性可分別檢測到7ml中5×104pfu和10ml中71pfu的HSV,而其它病毒不能引起溶解。預先用游離anti-HSV-gD處理HSV後,不再引起脂質體溶解,可以看出該方法的抗原特異性及高度靈敏性。與傳統的ELISA相比,該方法簡便省時,不需要多次的沖洗和孵育等步驟。
與普通脂質體一樣,靶敏感脂質體也存在血漿穩定的問題;脂質體與靶結合後,內容物釋放於靶細胞外,因此傳輸的藥物限於能被快速轉入細胞內的小分子及能通過表面受體結合進入細胞內的大分子。
眾所周知,普通脂質體經聚乙二醇(PEG)修飾後,血中循環時間顯著延長;但是,對於靶敏感脂質體,摻入PEG延長血循環時間的同時,是否影響其靶誘導的去穩定特性,還有待於進一步的研究。