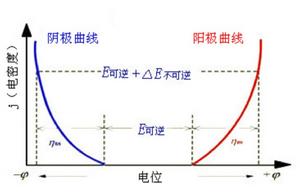
基本概念
通常把在—定電流密度作用下的電極電位與相對平衡的電極電位的差值,稱為電極極化。常見的有電極極化有電化學極化和濃差極化。
一個電極,在可逆情況下,電極上有一定的帶電程度,建立了相應的電極電勢 j 。當有電流通過電極時,若電極一溶液界面處的電極反應進行得不夠快,導致電極帶電程度的改變,也可使電極電勢偏離 j 。以電極(Pt)H(g)|H 為例,作為陰極發生還原作用時,由於H 變成H的速率不夠快,則有電流通過時到達陰極的電子不能被及時消耗掉,致使電極比可逆情況下帶有更多的負電,從而使電極電勢變得比 j 低,這一較低的電勢能促使反應物活化,即加速H 轉化成H。當(Pt)H(g)|H 作為陽極發生氧化作用時,由於H變成H 的速率不夠快,電極上因有電流通過而缺電子的程度較可逆情況時更為嚴重,致使電極帶有更多的正電,從而電極電勢變得比 j 高。這一較高的電勢有利於促進反應物活化,加速使H變為H 。將此推廣到所有電極,可得具有普遍意義的結論:當有電流通過時,由於電化學反應進行的遲緩性造成電極帶電程度與可逆情況時不同,從而導致電極電勢偏離 j 的現象,稱為電化學極化。
因電化學極化而造成的電極電勢 j 與 j 之差的絕對值,稱為“活化過電勢”。活化過電勢的大小是電化學極化的量度 。
電極極化的規律- --Tafel方程
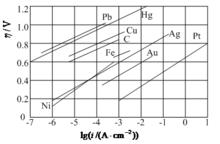
實驗表明,在電解過程中,除了Fe、Co、Ni等一些過渡元素的離子之外,一般金屬離子在陰極上還原成金屬時,活化過電勢的數值都比較小。但在有氣體析出時,例如在陰極析出H、陽極上析出O或C1時,活化過電勢的數值相當大。由於氣體的活化過電勢相當大,而且在電化學工業中又經常遇到與氣體活化過電勢有關的實際問題,因此對其研究比較多。1905年,塔菲爾(Tafel)在研究氫氣的活化過電勢與電流密度I的關係時曾提出如下經驗關係:
h = a + blg i
稱為塔菲爾公式。其中a和b是經驗常數。下表列出部分金屬上析出H時a和b的數值。
| 電極材料 | Ag | A1 | Co | Cu | Fe | Hg | Mn | Ni | Pb | Pb | Pt | Sn | Zn |
| a / V | 0.95 | 1.00 | 0.62 | 0.87 | 0.70 | 1.41 | 0.8 | 0.63 | 1.56 | 0.24 | 0.10 | 1.20 | 1.24 |
| b / V | 0.10 | 0.10 | 0.14 | 0.12 | 0.12 | 0.11 | 0.10 | 0.11 | 0.11 | 0.30 | 0.03 | 0.13 | 0.12 |
分析表中數據可以看出,對於不同的電極材料, a值可以相差很大,而 b值卻近似相同,大約為0.12V(Pt、Pd等貴金屬除外)。這說明不同金屬上析出氫氣時產生活化過電勢的原因有其內在的共同性。由上式可見,氫氣的活化過電勢 h 與lgi成線性關係,如下圖所示。值得指出,當電流密度非常小時,塔菲爾公式是不適用的。
 電化學極化
電化學極化後來的研究發現,氧等氣體析出時的活化過電勢與電流密度的關係也有類似於塔菲爾公式的形式。
過電勢的測量
測量電極的過電勢,一般採用如圖所示的裝置。帶有攪拌器的電解池A中有面積已知的待測電極B和輔助電極C,經一可變電阻D與直流電源E聯成迴路,內接有電流計M以測量迴路中的電流。改變電阻D可調節迴路中電流的大小,從而調節通過待測電極的電流密度 i。
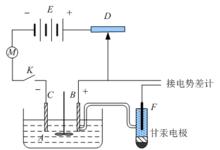 電化學極化
電化學極化將待測電極B與電勢已知的參比電極F(通常用甘汞電極)組成一個電池,接到電勢差計上,採用對消法測量該電池電動勢。應注意電極B、F與電勢差計組成的迴路上並無電流通過,因此根據E=j-j的關係,利用所測電動勢與參比電極電勢j甘汞)的數值,可算出待測電極的電勢j。j與對應的j相減所得絕對值就是過電勢 h。若測定時攪拌溶液比較充分,其值可視為是活化過電勢。若不攪拌或攪拌不充分,則為活化過電勢與濃差過電勢之和 。
影響電化學極化的因素
1、電極本身的影響,不同的電極,在相同的條件下發生電化學反應,其極化程度是不同的,由於各電極體系的i不同,a值也不同,固極化不同,其原因與構成電極的院子內部機構有關。
2、電流密度的影響,當通過電極的i增加,電化學極化增大,反之,極化減少,在實際生產中常常採用增加電極面積的方法或採用多孔電極的辦法來減少i值,使極化降低。
3、溫度的影響,在其他條件固定的情況下,一般升高溫度,電化學極化降低,反之,電化學極化增加,這是因為溫度升高,參加電化學反應的離子的能量增加,有助於克服反應的活化能壘,使反應速度加快。
4、其它因素的影響,如電解質溶液的組成,pH值得大小以及電解液中微量雜質對電化學極化都有影響 。