陽極溶出伏安法
正文
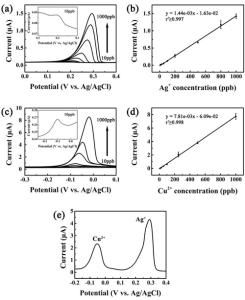
一種靈敏度很高、用於痕量組分的電化學分析法。如果用懸汞電極代替一般極譜法中的滴汞電極,同樣可以得到適用於定量測定的極譜波。在圖1a 中,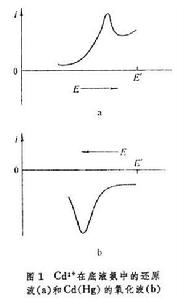 汞電極是陰極,電極上起的是還原反應:
汞電極是陰極,電極上起的是還原反應: Cd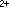 +2e+Hg─→Cd(Hg)
+2e+Hg─→Cd(Hg)
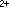 就在電極上被還原而生成汞齊。電解一段時間以後,汞中的Cd已達到一定濃度,然後把 883型極譜儀的分壓輪扳到“退”的位置,讓懸汞電極的電位從-1伏向零電位的方向移動,就得到圖1b中 Cd的氧化波。這時的電極反應為:
就在電極上被還原而生成汞齊。電解一段時間以後,汞中的Cd已達到一定濃度,然後把 883型極譜儀的分壓輪扳到“退”的位置,讓懸汞電極的電位從-1伏向零電位的方向移動,就得到圖1b中 Cd的氧化波。這時的電極反應為: Cd(Hg)─→Cd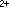 +2e+Hg
+2e+Hg
預電解 這是第一步操作,即將被測定的金屬離子在一定的電位(相當於該離子的陰極波上產生極限電流的電位)下,部分地還原為金屬,該金屬或者溶解在汞電極中,或者在電極表面析出。為了加速電解過程,溶液要進行攪拌。預電解是一個富集過程,預電解的時間愈長,溶出的時間愈短,則靈敏度愈高,能把已有的極譜法的靈敏度提高2~4個數量級。如果預電解的時間為τ,預電解電流為I,溶出時間為t,溶出的峰電流為ip,則得:
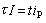
陽極溶出伏安法的峰電流部分地決定於預電解,部分地決定於溶出技術。以懸汞電極為例,如果預電解時間不長,樣品溶液的體積又足夠大,則預電解電流實際上保持不變,如果電極上析出的金屬摩爾數為Μ,則得:
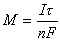
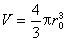 (r0為懸汞的半徑),則懸汞電極中金屬在汞中的濃度為:
(r0為懸汞的半徑),則懸汞電極中金屬在汞中的濃度為: 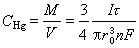
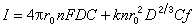
陽極溶出 是以一定的方式使微電極的電位由負向正的方向移動,使電極內的金屬重新氧化而產生氧化電流的過程。如果在單掃描極譜儀上進行陽極溶出,則在懸汞電極上得到的溶出峰電流為:
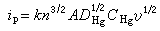
由以上公式可知,最後得到的溶出峰電流不但決定於被測金屬的濃度,也決定於預電解的時間、攪拌速度、懸汞的半徑和溶出時電極電位改變的速率。因此,要使實驗結果的重現性好,必須嚴格控制實驗條件。
電極 懸汞電極的優點是重現性好,缺點是:①電極面積與體積之比小,使靈敏度低,溶出峰寬;②為了防止汞滴下落,攪拌速度要慢;③需要用滴汞電極提供汞滴。
汞膜電極(鉑球鍍銀沾汞)的優點有:①面積與體積之比大,靈敏度高,溶出峰窄;②鏇轉電極或攪拌溶液的速度快;③使用方便。汞膜電極的缺點有:①重現性差;②需要有其他金屬作襯底,其中銀、鎳、鉑等的超電壓低,而且微溶於汞,襯底金屬與被襯金屬之間可能生成金屬間化合物,使溶出峰重現性差。
玻璃碳汞電極以玻璃碳為襯底,克服了汞膜電極會形成金屬間化合物的缺點。
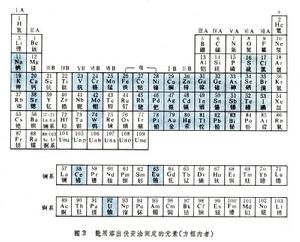
套用 可用陽極和陰極溶出伏安法測定的元素有40種左右(圖2 )。
 陽極溶出伏安法
陽極溶出伏安法