解釋
基本解釋:能形成 銅鏡的反應,由硫酸銅與氫氧化鈉反應,生成氫氧化銅,再用乙醛還原,即有紅色的氧化亞銅沉澱產生,在試管壁上形成銅鏡。常用此反應檢驗醛基的存在。 詞語分開解釋: 銅鏡 : 古代用來照映形象的銅製鏡子。一般是圓形,照面的一面磨光發亮,背面常鑄花紋。中國最早的銅鏡出現於新石器時代,戰國時已很盛行。 反應 : ① 有機體受到體內或體外的刺激而引起的相應的活動。 ②化學反應。 ③打針或服藥所引起的嘔吐、發燒、頭痛、腹痛等症狀。 ④原子核受到外力作用而發生變化:熱核~。 ⑤事情所引起的意見、態度或行動:他的演說引起了不同的~。
實驗目的
 葡萄糖的銀鏡反應
葡萄糖的銀鏡反應研究生成金屬鏡的條件,掌握相關的實驗操作。
實驗器材
 葡萄糖的銀鏡反應
葡萄糖的銀鏡反應舉例:
試管、試管夾、酒精燈、培養皿、台秤、角匙、石棉網、10%氫氧化鈉溶液、5%硝酸銀溶液、0.5M氨水、6M氨水、固體硝酸銀(cp)、7%硫酸銅溶液、6M鹽酸、3%葡萄糖溶液、37%甲醛溶液、*甲酸鈉溶液、**酒石酸鉀鈉溶液、銀氨溶液、10%氯化亞錫溶液。
甲酸鈉溶液:10g氫氧化鈉置於燒杯中,慢慢滴定4.5ml甲酸鈉溶液(邊滴邊攪拌),加100ml蒸餾水即成。
酒石酸鉀鈉溶液:四水酒石酸鉀鈉8g和氫氧化鈉2.6g加到20ml蒸餾水中。
銀氨溶液:試管中加1 ml 5%硝酸銀溶液,加1滴5%氫氧化鈉溶液,在不斷振盪下滴加稀氨水至沉澱剛好溶解為止。
10%氯化亞錫溶液 : 秤取2克氯化亞錫,先溶於少量6M鹽酸中,再稀釋至20ml。
實驗步驟
舉例:
1、用肥皂洗淨手,用去污粉將培養皿擦洗乾淨,再把洗滌劑放在小燒杯中加水溶解,加熱至80C,將它倒入培養皿中,靜置冷至室溫,傾去後分別用水和 蒸餾水全面淋洗,備用。
2、將20ml氯化亞錫溶液倒入培養皿中,靜止5分鐘後傾去,用蒸餾水小心淋洗,待乾。
3、在50ml燒杯中加入2滴5%硝酸銀和1滴氫氧化鈉溶液,逐滴加入0.5M氨水至沉澱剛好溶解,加入15 ml蒸餾水,攪拌後再加入3ml 3%葡萄糖溶液,混合後立即倒入培養皿中,靜置5分鐘,當溶液呈棕色後傾去,用蒸餾水小心淋洗,再用烘箱烘乾或晾乾。
4、50ml燒杯中充分混合等體積(約各7ml )7%的硫酸銅溶液、酒石酸鉀鈉溶液和37%甲醛溶液。立即倒入培養皿中,靜置5分鐘即可形成銅鏡。
實驗原理
舉例1:
從標準電極電勢值可知:Cu,Ag, Hg, Hg 和相應的 化合物具有氧化性,均為中強氧化劑。
Cu溶液中加入KI時,I被氧化為I ,Cu被還原得到白色CuI沉澱,CuI能溶於過量KI中形成配離子。
2Cu+4I===2CuI (白色)+I
CuCl 溶液中加入Cu屑,與濃HCl共煮得到棕黃色[CuCl ]配離子。CuCl +Cu(s)+2HCl(濃)===2H[CuCl ](棕黃色)
生成的配離子[CuCl ]不穩定,加水稀釋時,可得到白色的CuCl沉澱。
鹼性介質中,Cu與葡萄糖共煮,Cu被還原成Cu O紅色沉澱。
2Cu+4OH(過量)+C H O ===Cu O (紅)+2H O+C H O
或2[Cu(OH) ]+C H O ===Cu O (紅)+4OH+2H O+C H O
此反應稱為“銅鏡反應”
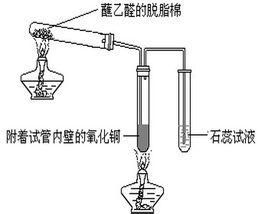
舉例2:
2Cu(NO ) ═2CuO+4NO ↑+O ↑
CH CHO+CuO═Cu+CH COOH
實驗用途
舉例:
鞏固 硝酸鹽分解、乙醛性質等知識,培養學生的觀察能力和實驗能力。
注意事項
舉例:
1. 溴乙烷在純水中水解很微弱,在溴乙烷中直接加入稀硝酸和硝酸銀溶液,不出現淺黃色沉澱,即用硝酸銀試劑檢驗不出有Br 存在。
2.溶液必須先酸化(即稀硝酸的量要加足),再加入硝酸銀溶液,否則Ag 在鹼性條件下遇OH 會變黑,干擾檢驗Br 的反應。(注意化學情景,有一些反應必須在鹼性情景下進行的,如銀鏡反應、銅鏡反應,以及鹼性電池等,有些要在酸性情景下進行,如高錳酸鉀酸性溶液、洗液、鉛蓄電池,以及該反應等。