發展歷史
1865年,貝開托夫在實驗的基礎上,根據金屬和金屬離子間相互置換能力的大小,以及金屬跟酸、跟水等反應的劇烈程度,首先確定了金屬活動性順序,在這個順序里已包括了氫。因為氫可以被位於它前面的金屬從稀酸里置換出來,而氫後面的金屬不能從酸中置換出氫。
在電化學得到發展後,金屬活動性的衡量尺度變為金屬的標準電極電勢,電勢越負者還原性越強,金屬活動性也越強。
註:由此可以看出,金屬活動性與金屬性是不同的概念,不可混為一談。金屬在水中的活動性也不能體現金屬在所有情況下的性質,例如鉀的金屬活動性強於鈉,但鈉可以置換出熔融氯化鉀中的鉀。
影響因素
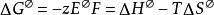 金屬活動性
金屬活動性決定金屬活動性的函式是金屬的標準電極電勢( E )與與水反應的標準吉布斯自由能(△ G ),它們的計算公式及之間的轉化公式為: ,因此電極電勢越負,自由能越大,活動性也越強。
自由能的一個影響因素是焓變(△ H)。金屬單質在水中形成陽離子時,經歷了升華,電離,水合三步,這三步中都有能量變化,決定了總反應焓變,對金屬的活動性有很大影響。因此在分析金屬活動性成因時,要綜合考慮金屬的升華能、電離能與水合熱 。
一般來說,元素周期表內元素從上到下,從右到左有活動性增強趨勢,其本質原因是隨著金屬半徑增大,最外層電子數減少,其電離能與升華能均有下降,雖水合熱亦有下降,但前兩者已足夠彌補。但對於一些特殊的例子,如鋰,由於其半徑極小,水合熱足夠高,彌補了升華熱與電離能偏高的不足,導致它在水中的活動性甚至比銫還要高。
套用
化學
部分金屬的活動性順序如下 :
| 單質名稱 | 元素符號 | 對應離子 | 特徵性質 |
| 鉀 | K | K | |
| 鈣 | Ca | Ca | |
| 鈉 | Na | Na | |
| 鎂 | Mg | Mg | |
| 鋁 | Al | Al | |
| 鋅 | Zn | Zn | |
| 鐵 | Fe | Fe | |
| 錫 | Sn | Sn | |
| 鉛 | Pb | Pb | |
| 銅 | Cu | Cu | |
| 汞 | Hg | Hg | |
| 銀 | Ag | Ag | |
| 鉑 | Pt | Pt | |
| 金 | Au | Au |
由金屬活動性順序表可以得到以下結論 :
排在前面的金屬可以將排在後面的金屬從它們的金屬溶液中置換出來。(若金屬過於活潑, 則會直接與水反應,並不會與水中的金屬離子反應);
理論上講,金屬活動性表中鐵及排在其前的金屬均可置換出純水中的氫 ;
若只考慮氫離子的氧化性,排在氫(H)前的金屬才能和非氧化性酸反應,置換出氫;
排在越後的金屬越容易,也越先從它們的化合物中被置換出來;排在越前的金屬越容易,也越先把其他化合物中的金屬置換出來。
1.排在前面的金屬可以將排在後面的金屬從它們的金屬溶液中置換出來。(若金屬過於活潑, 則會直接與水反應,並不會與水中的金屬離子反應);
2.理論上講,金屬活動性表中鐵及排在其前的金屬均可置換出純水中的氫 ;
3.若只考慮氫離子的氧化性,排在氫(H)前的金屬才能和非氧化性酸反應,置換出氫;
4.排在越後的金屬越容易,也越先從它們的化合物中被置換出來;排在越前的金屬越容易,也越先把其他化合物中的金屬置換出來。
在判斷溶液中的置換反應能否發生,以及發生置換反應的次序時,使用它是一種很簡便的辦法。
生產
金屬活動性可以預言金屬礦石的提煉難易程度,如排在末位的一些金屬,加熱即可使他們從氧化物中分解出來,而排在最前面的金屬,則需要使用電解法(如鈉)或活潑金屬置換法(如鉀)來提取。
金屬活動性還可以預言金屬被腐蝕的難易程度,如金即使加熱也不與氧反應,而鐵、銅在空氣中會緩慢生鏽,鈉、鉀等金屬在空氣中則極容易與氧化合,一般只能現取現用。
完整的活動性順序
| Li* | Cs | Rb | K | Ra | Ba | Fr | Sr | Ca | Na | La | Pr | Nd | Pm | Sm | Eu | Ac |
| 鋰* | 銫 | 銣 | 鉀 | 鐳 | 鋇 | 鍅 | 鍶 | 鈣 | 鈉 | 鑭 | 鐠 | 釹 | 鉕 | 釤 | 銪 | 錒 |
| Gd | Tb | Am | Y | Mg | Dy | Tm | Yb | Lu | Ce | Ho | Er | Sc | Pu | Th | Be | Np |
| 釓 | 鋱 | 鎇 | 釔 | 鎂 | 鏑 | 銩 | 鐿 | 鑥 | 鈰 | 鈥 | 鉺 | 鈧 | 鈽 | 釷 | 鈹 | 鎿 |
| U | Hf | Al | Ti | Zr | V | Mn | Nb | Zn | Cr | Ga | Fe | Cd | In | Tl | Co | Ni |
| 鈾 | 鉿 | 鋁 | 鈦 | 鋯 | 釩 | 錳 | 鈮 | 鋅 | 鉻 | 鎵 | 鐵 | 鎘 | 銦 | 鉈 | 鈷 | 鎳 |
| Mo | Sn | Pb | D** | H** | Cu | Po | Hg | Ag | Ru | Os | Pd | Ir | Pt | Au | ||
| 鉬 | 錫 | 鉛 | 氘** | 氫** | 銅 | 釙 | 汞 | 銀 | 釕 | 鋨 | 鈀 | 銥 | 鉑 | 金 |
註:由於金屬活動性的判定依據是金屬的標準電極電勢,而金屬性只與金屬失電子能力有關,因此會產生金屬性與金屬活動性不一致的情況.。
另外,一些金屬的活動性會受到溶劑,酸鹼值,以及沉澱劑等的影響 ,而金屬活動性順序表的測定條件是熱力學標準狀況,此時pH=0,所以活動性順序只能作為大部分情況下適用的參照,在特殊情況下需要計算非標準電極電勢。
在水中,鋰是活動性最高的金屬。雖然鋰是鹼金屬中金屬性最弱的元素,但是由於鋰原子和離子半徑小,離子靜電場力較大,導致Li 的水合能特別高,掩蓋了鋰元素升華能與電離能偏高的短板,使其成為水中活動性最高的金屬。而鋰與水的反應緩慢,一方面是因為鋰的升華能和熔點相對較高,使反應在動力學上受阻;另一方面,同樣由於較高的水化能,反應產物氫氧化鋰的化學鍵共價傾向顯著、溶解度較小,剛開始會附著在鋰的表面阻礙反應,隨著氫氧化鋰的溶解,速率才稍有加快 。
一般認為同位素化學性質相同,但在氘中的中子會影響質子間的相互作用,所以實際上氘氣比氕氣活潑 。

