簡介
 酸鹼滴定法
酸鹼滴定法OHˉ+HC8H₄O6ˉ→C8H₄O6ˉ+H₂O如果酸、鹼不太弱,就可以在水溶液中用酸、鹼標準溶液滴定。離解常數[1]Ka和Kb是酸和鹼的強度標誌。當
酸或鹼的濃度為0.1Μ,而且Ka或Kb大於10-7時,就可以準確地滴定,一般可準確至0.2%(見滴定誤差)。多元酸或多元鹼是分步離解的,如果相鄰的離解常數相差較大,即大於104,就可以進行分步滴定,這種情況下準
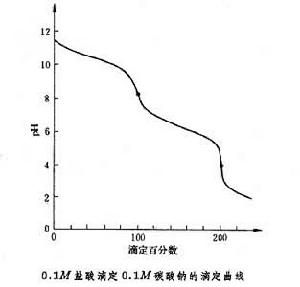
確度不高,誤差約為1%。鹽酸滴定碳酸鈉分兩步進行:
CO₃ˉ+H﹢→HCO₃ˉ
HCO₃ˉ+H﹢→CO₂↑+H₂O
相應的滴定曲線上有兩個等當點,因此可用鹽酸來測定混合物中碳酸鈉和碳酸氫鈉的含量,先以酚酞(最好用甲酚紅-百里酚藍混合指示劑)為指示劑,用鹽酸滴定碳酸鈉至碳酸氫鈉,再加入甲基橙指示劑,繼續用鹽酸滴定碳酸氫鈉為二氧化碳,由前後消耗的鹽酸的體積差可計算出碳酸氫鈉的含量。
某些有機酸或有機鹼太弱,或者它們在水中的溶解度小,因而無法確定終點時,可選擇有機溶劑為介質,情況就大為改善。這就是在非水介質中進行的酸鹼滴定(見非水滴定)。
有的非酸或非鹼物質經過適當處理可以轉化為酸或鹼。然後也可以用酸鹼滴定法測定之。例如,測定有機物的含氨量時,先用濃硫酸處理有機物,生成NH嬃,再加濃鹼並蒸出NH₃,經吸收後就可以用酸鹼滴定法測定,這就是克氏定氮法。又如測定海水或廢水中總鹽量時,將含硝酸鉀、氯化鈉的水流經陽離子交換柱後變成硝酸和鹽酸,就可以用標準鹼溶液滴定。
定義及套用
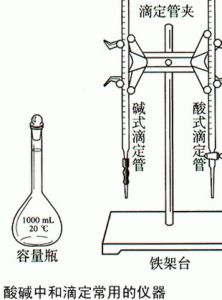
也稱中和法,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼,用鹼作滴定劑可以測定酸,這是一種用途極為廣泛的分析方法(見彩圖)。最常用的酸標準溶液是鹽酸,有時也用硝酸和硫酸。標定它們的基準物質是碳酸鈉Na2CO3: 酸鹼滴定法
酸鹼滴定法 酸鹼滴定法
酸鹼滴定法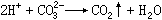
OH+HC8H4O宮─→C8H4O婇+H2O
如果酸、鹼不太弱,就可以在水溶液中用酸、鹼標準溶液滴定。離解常數Ka和Kb是酸和鹼的強度標誌。當酸或鹼的濃度為0.1Μ,而且Ka或Kb大於10時,就可以準確地滴定,一般可準確至0.2%(見滴定誤差)。多元酸或多元鹼是分步離解的,如果相鄰的離解常數相差較大,即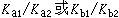 大於10,就可以進行分步滴定,這種情況下準確度不高,誤差約為1%。
大於10,就可以進行分步滴定,這種情況下準確度不高,誤差約為1%。 鹽酸滴定碳酸鈉分兩步進行:
CO娫+H─→HCO婣
HCO婣+H─→CO2↑+H2O
相應的滴定曲線上有兩個等當點,因此可用鹽酸來測定混合物中碳酸鈉和碳酸氫鈉的含量,先以酚酞(最好用甲酚紅-百里酚藍混合指示劑)為指示劑,用鹽酸滴定碳酸鈉至碳酸氫鈉,再加入甲基橙指示劑,繼續用鹽酸滴定碳酸氫鈉為二氧化碳,由前後消耗的鹽酸的體積差可計算出碳酸氫鈉的含量。
某些有機酸或有機鹼太弱,或者它們在水中的溶解度小,因而無法確定終點時,可選擇有機溶劑為介質,情況就大為改善。這就是在非水介質中進行的酸鹼滴定(見非水滴定)。有的非酸或非鹼物質經過適當處理可以轉化為酸或鹼。然後也可以用酸鹼滴定法測定之。例如,測定有機物的含氨量時,先用濃硫酸處理有機物,生成NH嬃,再加濃鹼並蒸出NH3,經吸收後就可以用酸鹼滴定法測定,這就是克氏定氮法。又如測定海水或廢水中總鹽量時,將含硝酸鉀、氯化鈉的水流經陽離子交換柱後變成硝酸和鹽酸,就可以用標準鹼溶液滴定。
酸鹼滴定法在工、農業生產和醫藥衛生等方面都有非常重要的意義。三酸、二鹼是重要的化工原料,它們都用此法分析。在測定製造肥皂所用油脂的皂化值時,先用氫氧化鉀的乙醇溶液與油脂反應,然後用鹽酸返滴過量的氫氧化鉀,從而計算出1克油脂消耗多少毫克的氫氧化鉀,作為製造肥皂時所需鹼量的依據。又如測定油脂的酸值時,可用氫氧化鉀溶液滴定油脂中的游離酸,得到 1克油脂消耗多少毫克氫氧化鉀的數據。酸值說明油脂的新鮮程度。糧食中蛋白質的含量可用克氏定氮法測定。很多藥品是很弱的有機鹼,可以在冰醋酸介質中用高氯酸滴定。測定血液中HCO婣的含量,可供臨床診斷參考。
基本原理
1.強酸強鹼的滴定
強酸和強鹼相互滴定的滴定反應為:
 滴定曲線
滴定曲線滴定開始前 pH=1.00
滴入NaO液19.98ml時 pH=4.30
化學計量點時 pH=7.00
滴入NaOH液20.02ml時 pH=9.70
從滴定曲線可以看出:
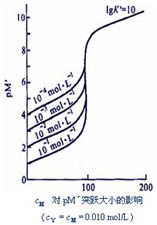
(1)根據滴定突躍選擇指示劑。滴定曲線顯示,滴定突躍(在計量點附近突變的pH值範圍)範圍很大,為4.30~9.70,凡是變色範圍全部或部分落在滴定突躍範圍內的指示劑都可以用來指示終點,所以酸性指示劑(甲基橙、甲基紅)和鹼性指示劑(酚酞)都可以用來指示強鹼滴定強酸的滴定終點。
(2)選擇滴定液的濃度。濃度大,突躍範圍寬,指示劑選擇範圍廣;但是,濃度太大,稱樣量也要加大,所以一般使用0.1mol/L濃度的滴度液。
2.強鹼滴定弱酸
滴定反應為:
以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)為例,滴定曲線如下圖:
滴定開始前 pH=2.88
滴入NaOH 液19.98ml時 pH=7.75
化學計量點時 pH=8.73
滴入NaOH液20.02ml時 pH=9.70
從滴定曲線可以看出:
(1)只能選擇鹼性指示劑(酚酞或百里酚酞等),不能選用酸性範圍內變色的指示劑(如甲基橙、甲基紅等)。因為突躍範圍較小,pH值在7.75~9.70之間;計量點在鹼性區。
(2)弱酸被準確滴定的判決是C•Ka>10-8。因為Ka愈大,突躍範圍愈大。而Ka<10-8時,已沒有明顯突躍,無法用指示劑來確定終點;另外,酸的濃度愈大,突躍範圍也愈大。
3.強酸滴定弱鹼
滴定反應為:
以HCl液(0.1000mol/L)滴定20.00mlNH3•H2O液(0.1000mol/L)為例,滴定曲線如下圖:
滴定開始前 pH=11.12
滴入HCl 液19.98ml時 pH=6.24
化學計量點時 pH=5.27
滴入HCl液20.02ml時 pH=4.30
從滴定曲線可以看出:
(1)只能選擇酸性指示劑(甲基橙或溴甲酚綠),不能選用鹼性範圍內變色的指示劑(酚酞)。
(2)弱鹼被準確滴定的判決是C•Kb>10-8。