概述
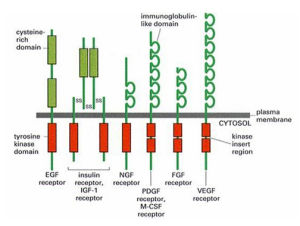
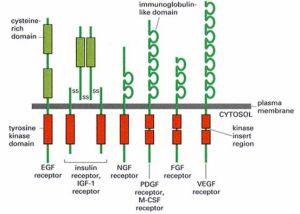 各類受體酪氨酸激酶
各類受體酪氨酸激酶酶偶聯型受體(enzymelinkedreceptor)分為兩類,其一是本身具有激酶活性,如肽類生長因子(EGF,PDGF,CSF等)受體;其二是本身沒有酶活性,但可以連線非受體酪氨酸激酶,如細胞因子受體超家族。這類受體的共同點是:①通常為單次跨膜蛋白[6];②接受配體後發生二聚化而激活,起動其下游信號轉導。
已知六類:①受體酪氨酸激酶、②酪氨酸激酶連線的受體、③受體酪氨酸磷脂酶、④受體絲氨酸/蘇氨酸激酶⑤受體鳥苷酸環化酶、⑥組氨酸激酶連線的受體(與細菌的趨化性有關)。
受體酪氨酸激酶
1、酪氨酸激酶
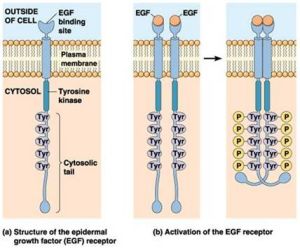 受體酪氨酸激酶的二聚化和自磷酸化
受體酪氨酸激酶的二聚化和自磷酸化酪氨酸激酶可分為三類:①受體酪氨酸激酶,為單次跨膜蛋白,在脊椎動物中已發現50餘種;②胞質酪氨酸激酶,如Src家族、Tec家族、ZAP70、家族、JAK家族等;③核內酪氨酸激酶如Abl和Wee。
受體酪氨酸激酶(receptorproteintyrosinekinases,RPTKs)的胞外區是結合配體結構域,配體是可溶性或膜結合的多肽或蛋白類激素,包括胰島素和多種生長因子。胞內段是酪氨酸蛋白激酶的催化部位,並具有自磷酸化位點。
配體(如EGF)在胞外與受體結合併引起構象變化,導致受體二聚化(dimerization)形成同源或異源二聚體,在二聚體內彼此相互磷酸化胞內段酪氨酸殘基,激活受體本身的酪氨酸蛋白激酶活性。這類受體主要有EGF、PDGF、FGF等。
2、信號分子間的識別結構域
信號轉導分子中存在著一些大約由50~100個胺基酸構成的結構域,它們在不同的信號轉導分子中具有很高的同源性。這些結構域的作用是在細胞中介導信號介導分子的相互識別和連線,共同形成不同的信號轉導途徑(Signaltransductionpathway),如電腦的接口一樣把不同的設備連線起來,形成信號轉導網路(Signaltransductionnetwork)。與細胞信號分子識別有關的結構域主要有:
SH2結構域(SrcHomology2結構域):約100個胺基酸組成,介導信號分子與含磷酸酪氨酸的蛋白分子結合。
SH3結構域(SrcHomology3結構域):約50~100個胺基酸組成,介導信號分子與富含脯氨酸的蛋白分子結合。
PH結構域(PleckstrinHomology結構域):約100~120個胺基酸組成,可以與膜上磷脂類分子PIP2、PIP3、IP3等結合,使含PH結構域蛋白由細胞質中轉位到細胞膜上。
3、RAS信號途徑
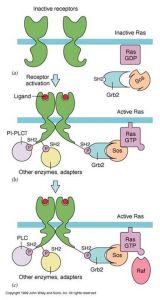 RAS信號途徑
RAS信號途徑受體酪氨酸激酶(RPTK)結合信號分子,形成二聚體,並發生自磷酸化而活化,活化的RPTK激活RAS,由活化的RAS引起蛋白激酶的磷酸化級聯反應。
Ras蛋白要釋放GDP,結合GTP的才能激活,GDP的釋放需要鳥苷酸交換因子(GEF,如Sos)參與;Sos有SH3結構域,但沒有SH2結構域,因此不能直接和受體結合,需要接頭蛋白(如Grb2)的連線,接頭蛋白通過SH2與受體的磷酸酪氨酸殘基結合,再通過SH3與Sos結合,Sos與膜上的Ras接觸,從而活化Ras。
Ras本身的GTP酶活性不強,需要GTP酶活化蛋白(GAP)的參與,使Ras結合的GTP水解而失活,GAP具有SH2結構域可直接與活化的受體結合。
Ras蛋白與Raf的N端結構域結合併使其激活,Raf是絲氨酸/蘇氨酸(Ser/Thr)蛋白激酶(又稱mapkkK)
活化的Raf結合併磷酸化另一種蛋白激酶MAPKK,使其活化。
MAPKK又使MAPK的蘇氨酸和酪氨酸殘基使之激活。
MAPK為有絲分裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK),屬絲氨酸/蘇氨酸殘激酶。活化的MAPK進入細胞核,可使許多轉錄因子活化,如將Elk-1激活,促進c-fos,c-jun的表達。
RPTK-Ras信號通路可概括如下:
配體→RPTK→adaptor→GEF→Ras→Raf(MAPKKK)→MAPKK
→MAPK→進入細胞核→轉錄因子→基因表達。
4.胰島素受體介導的信號轉導
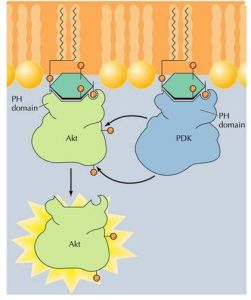 蛋白激酶B的活化
蛋白激酶B的活化胰島素受體也屬於受體酪氨酸激酶,是由α和β兩種組成四聚體型受體,其中β亞基具有激酶活性,可將胰島素受體底物(insulinreceptorsubstrates,IRSs)磷酸化(圖8-28),IRS作為多種蛋白的停泊點,可以結合或激活具有SH2結構域的蛋白。如磷脂醯肌醇3-激酶(phosphotidylinositol3-kinase,PI3K)。
PI3K催化PI形成PI(3,4)P2和PI(3,4,5)P3,這兩種磷酸肌醇可作為胞內信號蛋白(含PH結構域)的停泊位點,激活這些蛋白。其信號通路主要有:
①通過激活BTK(Bruton'styrosinekinase),再激活磷脂酶Cγ(PLCγ),引起磷脂醯肌醇途徑。
②激活磷脂醯肌醇依賴性激酶PKD1(phosphoinositoldependentkinase),PKD1激活轉位到膜上的蛋白激酶B(PKB,一種絲氨酸/蘇氨酸激酶,如Akt)。激活的PKB返回細胞質,將細胞調亡相關的BAD蛋白磷酸化,抑制BAD的活性,從而使細胞存活。
受體絲氨酸、蘇氨酸激酶
受體絲氨酸/蘇氨酸激酶(receptorserine/threoninekinases)是單次跨膜蛋白受體,在胞內區具有絲氨酸/蘇氨酸蛋白激酶活性,該受體以異二聚體行使功能。主要配體是轉化生長因子-βs。(transforminggrowthfactor-βs,TGF-βs。)家族成員,包括TGF-β1~TGF-β5,這些成員具有類似結構與功能,對細胞具有多方面的效應。依細胞類型不同,可能抑制細胞增殖、刺激胞外基質合成、刺激骨骼的形成、通過趨化性吸引細胞和作為胚胎髮育過程中的誘導信號等。
受體酪氨酸磷酯酶
受體酪氨酸磷酯酶(receptortyrosinephosphatases)為單次跨膜蛋白受體,受體胞內區具有蛋白酪氨酸磷酯酶的活性,胞外配體與受體結合激發該酶活性,使特異的胞內信號蛋白的磷酸酪氨酸殘基去磷酸化,其作用是控制磷酸酪氨酸殘基的壽命,使靜止細胞具有較低的磷酸酪氨酸殘基的水平。它的作用不是簡單的與RPTK相反,可能與酪氨酸激酶一起協同工作,如參與細胞周期調控。白細胞表面的CD45屬這類受體,對具體配體的尚不了解。
和酪氨酸激酶一樣存在胞質酪氨酸磷酯酶。胞質酪氨酸磷酯酶胞內段具有兩個SH結構域,稱作SHP1和SHP2,通過SHP1可以與細胞因子受體連線,使Jak去磷酸化,SHP1結構域缺陷的老鼠,各類血細胞異常。說明胞質酪氨酸磷酯酶與血細胞分化有關。
受體鳥苷酸環化酶
受體鳥苷酸環化酶(receptorguanylatecyclase)是單次跨膜蛋白受體,胞外段是配體結合部位,胞內段為鳥苷酸環化酶催化結構域。受體的配體心房排鈉肽(atrialnatriureticpeptides,ANPS)和腦排鈉肽(brainnatriureticpeptides,BNPs)。當血壓升高時,心房肌細胞分泌ANPs,促進腎細胞排水、排鈉,同時導致血管平滑肌細胞鬆弛,結果使血壓下降。介導ANP反應的受體分布在腎和血管平滑肌細胞表面。ANPs與受體結合直接激活胞內段鳥苷酸環化酶的活性,使GTP轉化為cGMP,cGMP作為第二信使結合併激活依賴cGMP的蛋白激酶G(PKG),導致靶蛋白的絲氨酸/蘇氨酸殘基磷酸化而活化。
除了與質膜結合的鳥苷酸環化酶外,在細胞質基質中還存在可溶性的鳥苷酸環化酶,它們是NO作用的靶酶,催化產生cGMP。
細胞因子受體超家族
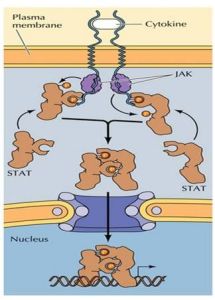 JAK-STAT信號途徑
JAK-STAT信號途徑屬於酪氨酸激酶連線的受體(tyrosinekinaseassociatedreceptor)。細胞因子(cytokine),如:白介素(IL)、干擾素(IFN)、集落刺激因子(CSF)、生長激素(GH)等,在造血細胞和免疫細胞通訊上起作用,這類細胞因子的受體為單次跨膜蛋白,本身不具有酶活性,但與配體結合後發生二聚化而激活,羅織或連線胞內酪氨酸蛋白激酶(如,JAK),其信號途徑為JAK-STAT或RAS途徑。
JAK(justanotherkinase或januskinase)是一類非受體酪氨酸激酶家族,已發現四個成員,即JAK1、JAK2、JAK3和TYK1,其結構不含SH2、SH3,C段具有兩個相連的激酶區。
JAK的底物為STAT,即信號轉導子和轉錄激活子(signaltransducerandactivatoroftranscription,STAT),具有SH2和SH3兩類結構域。STAT被JAK磷酸化後發生二聚化,然後穿過核膜進入核內調節相關基因的表達,這條信號通路稱為JAK-STAT途徑(圖8-30),可概括如下:
1、配體與受體結合導致受體二聚化;
2、二聚化受體激活JAK;
3、JAK將STAT磷酸化;
4、STAT形成二聚體,暴露出入核信號;
5、STAT進入核內,調節基因表達。