簡介
無論採用固體、液體或氣體原料,所製成的合成氨原料氣中均含有一氧化碳,其體積分數為12%~40%。一氧化碳不是合成氨的直接原料,而且能使氨合成催化劑中毒,因此,在送往合成工序之前,必須將一氧化碳脫除。一氧化碳的脫除分為兩步,首先,利用一氧化碳與水蒸氣作用生成二氧化碳和氫的變換反應,將大部分一氧化碳除去,這一過程稱為一氧化碳變換,反應後的氣體稱為變換氣,經變換反應既能把一氧化碳變為易除去的二氧化碳,同時又可製得等體積的氫,然後,再採用其他方法脫除變換氣中殘餘的少量一氧化碳。
工業生產中,一氧化碳變換反應均在催化劑存在的條件下進行。根據反應溫度不同,變換過程分為中溫變換和低溫變換。中溫變換催化劑以三氧化二鐵為主,反應溫度為350~550℃,反應後氣體中仍含有3%左右的一氧化碳。低溫變換以銅(或硫化鈷一硫化鉬)為催化劑主體,操作溫度為180~280℃,反應後氣體中殘餘一氧化碳可降到0.3%左右。
近年來,隨著高活性耐硫變換催化劑的開發和使用,變換工藝發生了很大變化,由過去單純的中溫變換、中低溫變換,發展到目前的中變串低變、全低低、中低低變換等多種新工藝。
變換反應的特點
變換反應可用下式表示:
CO+HO(g)→CO+H+41.2kJ
變換反應的特點是可逆、放熱、反應前後體積不變,並且反應速率比較慢,只有在催化劑的作用下才具有較快的反應速率。
變換反應是放熱反應,反應熱隨溫度升高而有所減少,不同溫度下變換反應的反應熱見下圖。在生產中,應充分回收利用變換反應熱,以便降低能耗。
 變換反應的反應熱
變換反應的反應熱變換反應平衡常數
在一定條件下,當變換反應達到平衡狀態時,其平衡常數為:
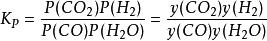 變換反應
變換反應式中:P(CO)、P(H)、P(CO)、P(HO)—各組分的平衡分壓,Pa;
y(CO)、y(H)、y(CO)、y(HO)—各組分的平衡組成,%。
不同溫度下,一氧化碳變換反應的平衡常數見下圖。變換反應的平衡常數隨溫度的升高而降低,因而降低溫度有利於變換反應向右進行,使變換氣中殘餘CO的含量降低。
 變換反應平衡常數
變換反應平衡常數變換反應催化劑選擇
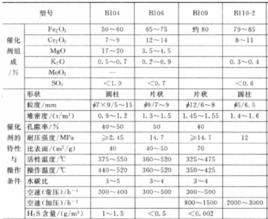
變換反應選用什麼催化劑,要根據生產工藝要求和具體情況而定。變換催化劑主要有鐵鎂系催化劑和鐵鉻系催化劑等中溫變換催化劑等。
1、鐵鎂系催化劑
鐵鎂系變換催化劑的主要成分是FeO、MgO、CrO,由於催化劑中含有較多的氧化鎂(17%~20%),為區別其他鐵、鉻催化劑,習慣上叫鐵鎂催化劑。該催化劑的主要活性組分在還原前是FeO3(晶相為α-FeO或γ-FeO),在投入變換爐後必須還原為FeO,才具有催化活性。
其變換反應溫度高達400~500℃,因此可稱為高溫變換催化劑或中溫變換催化劑。該催化劑最大的特點就是對有機硫化物有較好的轉化能力,能將煤氣中的硫氧化碳、二氧化硫等轉化為硫化氫:
COS+H→HS+CO
COS+HO→HS+CO
在CO變換過程中,COS的轉化率可達90%以上,同時對硫醇、羰基硫也有類似的反應。在以煤為原料的小型合成氨廠,主要依賴變換過程來完成有機硫的轉化。在聯醇工藝中,變換過程也是有機硫轉化的主要環節,通常還需串聯有機硫水解步驟。由於氧化鎂的存在,與H2S有以下反應:
MgO+HS→MgS+HO
當蒸汽含量增加或煤氣中HS含量減少時,該反應向逆反應方向移動,因此這類催化劑非常適合於含硫高的原料氣,通常HS含量在0.29/m 以下時,對催化劑活性沒有影響。當HS含量達到16~20g/m 時,催化劑活性略有下降,而一旦HS含量降低,即可恢復原來活性。但是,美中不足的是CO變換轉化率較低,蒸汽消耗較高。
2、鐵鉻系催化劑
鐵鉻系催化劑以FeO、CrO為主體,同時也含有少量MgO(3%~5%)。與鐵鎂系催化劑相比.其CO變換轉化率較高,蒸汽消耗也較低,其操作溫度為315~485℃,但對原料氣中硫化物含量要求較嚴格。其中CrO的加入對變換催化劑起一個結構穩定劑作用。加入CrO後,與FeO形成固溶體,可有效防止或延緩高溫燒結而使晶粒再結晶長大和表面積減小,提高催化劑的耐熱性能和機械強度,延長使用壽命。純FeO活性溫度很窄,耐熱性差,當汽氣比較低時,可能發生過度還原反應而生成FeO,甚至Fe,從而引起甲烷化和歧化反應,因此.在投入變換爐後必須還原為FeO才具有催化活性。
KO和CaO對Fe-Cr系變換催化劑有提高其活性和熱穩定性作用,是良好的助催化劑,其添加量以0.5%為最好。MgO能增強催化劑的耐熱和抗硫性能。