直接模板
翻譯模板翻譯模板proteinbiosynthesis
不同mRNA序列的分子大小和鹼基排列順序各不相同,但都具有5ˊ-端非翻譯區、開放閱讀框架區、和3ˊ-端非翻譯區;真核生物的mRNA的5ˊ-端還有帽子結構、3ˊ-端有長度不一的多聚腺苷酸(polyA)尾。帽子結構能與帽子結合,在翻譯時參與mRNA在核糖體上的定位結合,啟動蛋白質生物的合成;帽子結構和ployA尾的作用還有穩定RNA;開放閱讀框架區與編碼蛋白質的基因序列相對應。
遺傳密碼錶在mRNA的開放式閱讀框架區,以每3個相鄰的核苷酸為一組,代表一種胺基酸或其他信息,這種三聯體形勢稱為密碼子(codon)。如圖,通常的開放式閱讀框架區包含500個以上的密碼子。
遺傳密碼的特點一方向性:密碼子及組成密碼子的各鹼基在mRNA序列中的排列具有方向性(direction),翻譯時的閱讀方向只能是5ˊ→3ˊ。
二連續性:mRNA序列上的各個密碼子及密碼子的各鹼基是連續排列的,密碼子及密碼子的各個鹼基之間沒有間隔,每個鹼基唯讀一次,不重疊閱讀。
三簡併性:一種胺基酸可具有兩個或兩個以上的密碼子為其編碼。遺傳密碼錶中顯示,每個胺基酸都有2,3,4或6個密碼子為其編碼(除甲硫氨酸只有一個外),但每種密碼子只對應一個胺基酸,或對應終止信息。
四通用性:生物界的所有生物,幾乎都通用這一套密碼子表。
五擺動性:tRNA的最後一位,和mRNA的對應不完全,導致了簡併性。
合成場所
核糖體就像一個小的可移動的工廠,沿著mRNA這一模板,不斷向前迅速合成肽鏈。氨基醯tRNA以一種極大的速率進入核糖體,將胺基酸轉到肽鏈上,又從另外的位置被排出核糖體,延伸因子也不斷地和核糖體結合和解離。核糖體和附加因子一道為蛋白質合成的每一步驟提供了活性區域。
相關信息
胺基酸活化
 蛋白質合成
蛋白質合成在進行合成多肽鏈之前,必須先經過活化,然後再與其特異的tRNA結合,帶到mRNA相應的位置上,這個過程靠tRNA合成酶催化,此酶催化特定的胺基酸與特異的tRNA相結合,生成各種氨基醯tRNA.每種胺基酸都靠其特有合成酶催化,使之和相對應的tRNA結合,在氨基醯tRNA合成酶催化下,利用ATP供
能,在胺基酸羧基上進行活化,形成氨基醯-AMP,再與氨基醯tRNA合成酶結合形成三聯複合物,此複合物再與特異的tRNA作用,將氨基醯轉移到tRNA的胺基酸臂(即3'-末端CCA-OH)上(圖1)。
簡介
原核細胞中起始胺基酸活化後,還要甲醯化,形成甲醯蛋氨酸tRNA,由N10甲醯四氫葉酸提供甲醯基。而真核細胞沒有此過程。前面講過運載同一種胺基酸的一組不同tRNA稱為同功tRNA。一組同功tRNA由同一種氨醯基tRNA合成酶催化。氨基醯tRNA合成酶對tRNA和胺基酸兩者具有專一性,它對胺基酸的識別特異性很高,而對tRNA識別的特異性較低。氨基醯tRNA合成酶是如何選擇正確的胺基酸和tRNA呢?按照一般原理,酶和底物的正確結合是由二者相嵌的幾何形狀所決定的,只有適合的胺基酸和適合的tRNA進入合成酶的相應位點,才能合成正確的氨醯基tRNA。現在已經知道合成酶與L形tRNA的內側面結合,結合點包括接近臂,DHU臂和反密碼子臂(圖2)。氨基醯-tRNA合成酶與tRNA的相互作用,可見氨酸接受柄、乍看起來,反密碼子似乎應該與胺基酸的正確負載有關,對於某些tRNA也確實如此,然而對於大多數tRNA來說,情況並非如此,人們早就知道,當某些tRNA上的反密碼子突變後,但它們所攜帶的氨工酸卻沒有改變。1988年,候稚明和Schimmel的實驗證明丙氨酸tRNA酸分子的胺基酸臂上G3:U70這兩個鹼基發生突變時則影響到丙氨醯tRNA合成酶的正確識別,說明G3:U70是丙氨酸tRNA分子決定其本質的主要因素。tRNA分子上決定其攜帶胺基酸的區域叫做副密碼子。一種氨基醯tRNA合成酶可以識別以一組同功tRNA,這說明它們具有共同特徵。例如三種丙氨酸tRNA(tRNAAlm/CUA,tRNAAim/GGC,tRNAAin/UGC都具有G3:U70副密碼子。)但沒有充分的證據說明其它氨基醯tRNA合成酶也識別同功tRNA組中相同的副密碼子。另外副密碼子也沒有固定的位置,也可能並不止一個鹼基對。
多肽鏈
核蛋白體大小亞基,mRNA起始tRNA和起始因子共同參與肽鏈合成的起始。
1、大腸桿菌細胞翻譯起始複合物形成的過程:
⑴核糖體30S小亞基附著於mRNA起始信號部位:原核生物中每一個mRNA都具有其核糖體結合位點,它是位於AUG上游8-13個核苷酸處的一個短片段叫做SD序列。這段序列正好與30S小亞基中的16S rRNA3’端一部分序列互補,因此SD序列也叫做核糖體結合序列,這種互補就意味著核糖體能選擇mRNA上AUG的正確位置來起始肽鏈的合成,該結合反應由起始因子3(IF-3)介導,另外IF-1促進IF-3與小亞基的結合,故先形成IF3-30S亞基-mRNA三元複合物。
⑵30S前起始複合物的形成:在起始因子2作用下,甲醯蛋氨醯起 始tRNA與mRNA分子中的AUG相結合,即密碼子與反密碼子配對,同時IF3從三元複合物中脫落,形成30S前起始複合物,即IF2-3S亞基-mRNA-fMet-tRNAfmet複合物,此步需要GTP和Mg2+參與。
 蛋白質合成
蛋白質合成⑶70S起始複合物的形成:50S亞基上述的30S前起始複合物結合,同時IF2脫落,形成70S起始複合物,即30S亞基-mRNA-50S亞基-mRNA-fMet-tRNAfmet複合物。此時fMet-tRNAfmet占據著50S亞基的肽醯位。而A位則空著有待於對應mRNA中第二個密碼的相應氨基醯tRNA進入,從而進入延長階段,以上過程見圖3和圖4。
2、真核細胞蛋白質合成的起始真核細胞蛋白質合成起始複合物的形成中需要更多的起始因子參與,因此起始過程也更複雜。
⑴需要特異的起始tRNA即,-tRNAfmet,並且不需要N端甲醯化。已發現的真核起始因子有近10種(eukaryote Initiation factor,eIF)
⑵起始複合物形成在mRNA5’端AUG上游的帽子結構,(除某些病毒mRNA外)
⑶ATP水解為ADP供給mRNA結合所需要的能量。
真核細胞起始複合物的形成過程是:
翻譯起始也是由eIF-3結合在40S小亞基上而促進80S核糖體解離出60S大亞基開始,同時eIF-2在輔eIF-2作用下,與Met-tRNAfmet及GTP結合,再通過eIF-3及eIF-4C的作用,先結合到40S小亞基,然後再與mRNA結合。mRNA結合到40S小亞基時,除了eIF-3參加外,還需要eIF-1、eIF-4A及eIF-4B並由ATP水解為ADP及Pi來供能,通過帽結合因子與mRNA的帽結合而轉移到小亞基上。但是在mRNA5’端並未發現能與小亞基18SRNA配對的S-D序列。目前認為通過帽結合後,mRNA在小亞基上向下游移動而進行掃描,可使mRNA上的起始密碼AUG在Met-tRNAfmet的反密碼位置固定下來,進行翻譯起始。
肽鏈步驟
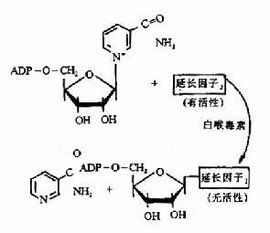
多肽鏈的延長在多肽鏈上每增加一個胺基酸都需要經過進位,轉肽和移位三個步驟。⑴為密碼子所特定的胺基酸tRNA結合到核蛋白體的A位,稱為進位。氨基醯tRNA在進位前需要有三種延長因子的作用,即,熱不穩定的E(Unstable temperature,EF)EF-Tu,熱穩定的EF(stable temperature EF,EF-Ts)以及依賴GTP的轉位因子。EF-Tu首先與GTP結合,然後再與氨基醯tRNA結合成三元複合物,這樣的三元複合物才能進入A位。此時GTP水解成GDP,EF-Tu和GDP與結合在A位上的氨基醯tRNA分離。
多肽鏈詳情
一級結構加工修飾
⑴N端甲醯蛋氨酸或蛋氨酸的切除:N端甲醯蛋氨酸是多肽鏈合成的起始胺基酸,必須在多肽鏈折迭成一定的空間結構之前被切除。其過程是:① 去甲醯化;② 去蛋氨醯基。
⑵胺基酸的修飾:由專一性的酶催化進行修飾,包括糖基化、羥基化、磷酸化、甲醯化等。
⑶二硫鍵的形成:由專一性的氧化酶催化,將-SH氧化為-S-S-。
⑷肽段的切除:由專一性的蛋白酶催化,將部分肽段切除。
高級結構的形成
⑴構象的形成:在分子內伴侶、輔助酶及分子伴侶的協助下,形成特定的空間構象。
⑵亞基的聚合。⑶輔基的連線。
靶向輸送
蛋白質合成後,定向地被輸送到其執行功能的場所稱為靶向輸送。大多數情況下,被輸送的蛋白質分子需穿過膜性結構,才能到達特定的地點。因此,在這些蛋白質分子的氨基端,一般都帶有一段疏水的肽段,稱為信號肽。分泌型蛋白質的定向輸送,就是靠信號肽與胞漿中的信號肽識別粒子(SRP)識別並特異結合,然後再通過SRP與膜上的對接蛋白(DP)識別並結合後,將所攜帶的蛋白質送出細胞。
信號肽假說:信號肽位於新合成的分泌蛋白N端。對分泌蛋白的靶向運輸起決定作用。①細胞內的信號肽識別顆粒(SRP)識別信號肽,使肽鏈合成暫時停止,SRP引導核蛋白體結合粗面內質網膜;②SRP識別、結合內質網膜上的對接蛋白,水解GTP使SRP分離,多肽鏈繼續延長;③信號肽引導延長多肽進入內質網腔後,經信號肽酶切除。分泌蛋白在高爾基體包裝成分泌顆粒出胞。
生物調控
蛋白質合成的調控
生物體內蛋白質合成的速度,主要在轉錄水平上,其次在翻譯過程中進行調節控制。它受性別、激素、細胞周期、生長發育、健康狀況和生存環境等多種因素及參與蛋白質合成的眾多的生化物質變化的影響。由於原核生物的翻譯與轉錄通常是偶聯在一起的,且其mRNA的壽命短,因而蛋白質合成的速度主要由轉錄的速度決定。弱化作用是一個通過翻譯產物的過量與不足首先影響轉錄,從而調節翻譯速度的一種方式。mRNA的結構和性質也能調節蛋白質合成的速度。
HCR兩種狀態
真核生物轉錄與翻譯不是偶聯的,通常蛋白質合成的速度比原核生物慢。真核生物除了主要通過轉錄和轉錄後加工及mRNA的結構和性質(如帽子結構和多聚A尾巴等)(見信使核糖核酸)進行調控外,通過對珠蛋白生物合成研究表明,真核起始因子eIF-2是翻譯速度的限制因子,因此影響eIF-2的因素能調節翻譯的速度。用哺乳動物網織紅細胞的無細胞製劑進行離體研究指出,當缺乏血紅素時,因為無法形成血紅蛋白,沒有必要合成蛋白質。實驗證明血紅素的調控是通過一種稱為血紅素調控阻遏物(HCR)實現的。HCR有活潑和不活潑的兩種狀
血紅素的影響
血紅素通過影響eIF-2對蛋白質進行調控。當血紅素存在時,抑制了胞蛋白質合成,而且還能促進通常不合成血紅蛋白的細胞合成蛋白質,如促進肝癌細胞、海拉細胞和腹水瘤細胞無細胞製劑的蛋白質合成。
蛋白質抑制劑
蛋白質生物合成的抑制劑 許多蛋白質生物合成抑制劑具有高度專一性,這對於研究合成機制很重要。許多臨床有效的抗生素是通過特異抑制原核生物的蛋白質合成而發揮作用的,它們抑制細菌生長而不損害人體細胞。利用兩類生物蛋白質合成的差異,可以找出治療細菌感染引起的疾病的藥物。表中列出一些較為重要的蛋白質生物合成抑制劑及其作用部位和專一性。