概述
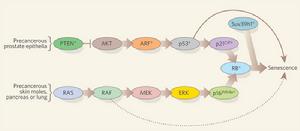 致癌基因引發的衰老
致癌基因引發的衰老致癌基因 oncogene 最初是定義為病毒攜帶的、能夠引起靶細胞的轉化基因。大部分病毒性癌基因具有細胞副本,參與正常細胞功能,這些細胞基因稱為原癌基因(Proto-Oncogenes),並在特定情況下它們在細胞中的變異或異常活性與腫瘤形成息息相關。目前已有100 種癌基因被鑑定。這些致癌基因分為幾個類群,分別代表從跨膜蛋白質到轉錄因子的不同活性類型,其功能的確定可能會解釋腫瘤形成種許多類型的變化。一個癌基因的產生代表一種功能的獲得,其中細胞原癌基因被異常激活。這可能是蛋白質或組成活性發生了變異、過量表達或適當時候停止表達。
致癌基因(oncogenes)的發現,源自反轉錄病毒(retrovirus)可以將己身的RNA由反轉錄酶(reversetransCriptase)轉化成DNA後,將其輸送入宿主細胞(hostcell)的細胞核內,然後與宿主細胞之DNA相互嵌合的觀察。由於這類人侵病毒基因的致活化,於動物(如雞、鼠、貓、猴等)體內能衍生各種不同的癌瘤,基於此種事實,致癌基因最早的命名方式,常系以3個英文字母為代碼(three-lettercodes),如ras致癌基因,指的就是能在老鼠(rat)身上衍生肉瘤(sarcoma)的病毒基因。晚近隨著分子生物學,基因選植複製(genecloning)與基因製圖(genemapping)等生物科技的不斷發展進步,科學家目前已然知曉:許多與病毒致癌基因一模一樣的基因,其實原本就早已經存在人體細胞內,只不過此時基因不表現。只有在受到外來致癌原的連續刺激之後,才可能被激活過來,呈現出顯性致癌基因(dominantgenes)的特性。同時,新近陸續被發現出來的致癌基因,雖大致仍保有3個英文字母代碼的架構,然而其命名的章法,就沒有昔日那般刻板了。
常見致癌基因的致活化(activation),可藉由軀體細胞的基因突變(somaticmutation)來促成。而基因突變常見的機制有:染色體的易位(translocations)、缺失(deletions)、內翻(inver-sions)、增幅(amplification)等。至於致癌基因的產物(oncogeneproducts)在功能區分上則可以是生長因素(growthfactor)、生長因素的接受體(growthfactorreceptors),以及細胞訊息傳遞受動器(singnaltransduCtioneffectors),如酪氨酸蛋白致活酶f1(proteintyrosinekinases)與轉錄因素(transcriptionfactors)等。不論功能上是劃歸為哪一分類,當致癌基因被激活之後,藉由轉錄、轉譯出來的蛋白酶的促進,便能使細胞周期持續高檔運轉,細胞增生不斷,如此也為癌瘤的形成製造出一個有利的條件。
抑癌基因
抑癌基因(tumorsuppressorgenes,又稱antioncogenes)的蛋白質產物,通常是作用在細胞周期中的合成前期與合成期這兩個階段之間,調控細胞周期的促動酶,發揮“煞車”(brakes)的功能,以遏阻過度亢進的細胞增生與癌瘤的形成。抑癌基因常系隱性基因(recessivegenes),因此必須從父系與母系染色體中,先行發生了兩次基因突變的“打擊”之後,方才會喪失了抑癌基因的正常功能。最早被研究的抑癌基因為產制視網膜母細胞瘤蛋白(retinoblastomaprotein)的Rb-l基因。此類腫瘤的發生,需要同一對(也就是第13對)兩個染色體上之Rb-l基因,先後或同時地缺失後才能致癌。此種現象,我們稱之為雙重打擊的效應(two-hiteffect)。另一個常被提及的抑癌基因p53的蛋白質產物,本身即是一種轉錄因素,可以遏阻細胞進入細胞周期中的S階段,因而終止細胞的增生狀態。此外,p53基因產物也可以提供細胞一個修復DNA傷害的空檔期,或假使DNA傷害過巨,則也可以進而指引細胞啟動細胞凋亡的程式,兩者皆可減除癌瘤新生的機會。已知,為數已超出70%的致癌與抑癌基因中,以p53的缺失最為常見,約可見於人類半數左右的癌瘤種類上。
如上所述,癌症的發生乃係經由多步驟性致癌機制,驗證在近年來致癌基因與抑癌基因的相關研究上,此種理論在今日尤為貼切。舉例而言,大腸直腸癌的致癌過程中,先是有第5對染色體長臂(5q)上抑癌基因APC的缺失,遂由正常大腸黏膜上皮衍生成增生性息肉(hyperplasticpolyp)。其次發生的是位於第12對染色體長臂(12q)上的基因突變,激活了致癌基因K-ras,遂衍生成中期性腺瘤(intermediateadenoma)。更進一步,由於第18對染色體長臂上(18q),另一個抑癌基因DCC(deletedincoloncancer)的缺失,便形成晚期性腺瘤(lateadenoma)。此時,只要再加上第17對染色體短臂(17p)上p53抑癌基因的缺失後,此時便能衍生成大腸直腸癌。這一系列致癌與抑癌基因的逐步變化,終於導致癌病發生的連續過程,目前其他常見癌瘤如肺癌、胃癌、肝癌等,也正在進行相關的研究中。
致癌基因的狹義定義
(1)狹義的是指形成與細胞癌化有直接關係的蛋白質的基因。其典型的為肉瘤基因,在具有強烈致癌性的腫瘤病毒(Retroviridae)中發現了與細胞的癌化有關、但與病毒的增殖無關的數種肉瘤基因。另外從引起急性白血病的腫瘤病毒中發現數種急性白血病基因。這些致癌基因,已陸續證實都由正常細胞中存在的基因轉變而來。從與正常細胞中的致癌基因對應的基因,在多種動物中廣泛地存在著,認為它們對動物的生命來說還是有用的。關於癌腫的基因還未發現。
(2)上述肉瘤和急性白血病基因加上腺病毒的Ela、Elb區域,以及乳多空病毒(Papovavirus)的初期基因區域等,雖非來源於細胞的基因,但含有使細胞致癌的基因,屬於廣義的致癌基因,也稱為轉化基因(transforming gene)。
致癌基因調控的真相
美國波士頓BethIsraelDeaconess醫學中心(BIDMC)的科學家發現了調控著致癌基因MDM2的基因。MDM2又調控著腫瘤抑制蛋白質p53。但是這組科學家發現,這些基因並不是MDM2基因的“通斷”開關,而更像一個調光器開關,這提示了一個更複雜的信號傳導路徑,它對於變化的環境敏感。
 致癌基因的調控
致癌基因的調控在8月17日出版的《癌細胞》(CancerCell)雜誌上報告的這項關於上游基因的新發現涉及了p53細胞信號傳導路徑,該發現可能指出了幫助殺死腫瘤的新的藥物靶標。這項發現還指出了可能的癌症風險生物標記,有朝一日它們可能有助於患者採取針對癌症的預防措施。
p53防止身體出現腫瘤,在50%的癌症中它出了問題。p53被稱為基因組的衛士,它是一個由各種蛋白質組成的完善的防禦系統的一部分。它通過暫停正常的細胞分裂周期而讓細胞有時間修復日常環境攻擊造成的DNA損傷,從而防止癌症出現。如果這種損傷太嚴重而無法修復,p53就會觸發細胞死亡。
BethIsraelDeaconess醫學中心和哈佛大學醫學院的病理學助理教授WenyiWei說,由於p53具有破壞性,它以“陰陽”的方式存在——就像和對立面保持平衡。“當DNA受到破壞之後,MDM2後退,允許p53暫停細胞並進行修復,”Wei解釋說。“而當MDM2重新出現後,p53消失,細胞周期恢復正常。”然而,已知MDM2也是一種致癌基因,因為MDM2過多會完全制止p53,因此也就削弱了它的預防癌症的能力。
在這項新的研究中,Wei與其合作者發現,MDM2並非簡單地逐漸消失,而是通過一對酶的聯合作用而積極地降解。其中一個酶稱為酪蛋白激酶I(cki),當細胞探測到DNA損傷的時候它會被激活,儘管這種激活的細節尚不很清楚。它的工作是讓MDM2磷酸化,這會引發MDM2被另一種酶beta-TRCP1破壞。beta-TRCP1通過用一種稱為遍在蛋白的小蛋白質標記MDM2從而起作用,這就像給一件不想要的家具貼上“垃圾”的標籤。26S蛋白酶體然後就像垃圾收集者一樣清掃掉了MDM2,釋放出了p53的DNA修復工作。
有趣的是,Wei發現CKI對MDM2套用一個磷酸化標記不足以保證beta-TRCP1破壞這種蛋白質。“這更像是一個調光器開關而非一個通斷開關,”Wei說。該研究組發現了17到23個磷酸化位點——也就是這個蛋白質上的貼“垃圾”標籤的位置。“看上去細胞想要能夠適應環境,”Wei說。“不是徹底的是或者否,你給出一個逐漸的‘是’,然後是一個完全的‘是’,這個蛋白就被標記成需要被破壞了。”
“這項新的研究定義了DNA損傷之後MDM2如何被蛋白質降解所調控。儘管長久以來人們知道p53被激活了,這種情況發生的機制遠遠不那么清楚,”哈佛大學醫學院副教授WilliamHahn說。“這些類型的實驗可能最終實現用治療來干預這一發生機制的方法。”
由於半數以上的腫瘤的p53太少,一種正在開發中的現有治療策略就涉及到抑制腫瘤細胞的MDM2,進而讓p53進行它的修復工作或者破壞無法修復的細胞。
一種新的治療可能性是進一步走向這個信號傳導路徑的上游,去促進CKI。Wei猜測增加CKI的濃度可能減少MDM2並釋放p53。然而,Wei說:“製造一種拮抗劑從而抑制一種蛋白質比製造一種激動劑從而促進一種蛋白質更容易。”
另一種可能性是臨床科研人員可能希望研究臨床腫瘤樣本從而弄清楚CKI或beta-TRCP1是否在不同類型的癌症中變異。如果是這樣,這些變異可能成為癌症風險的生物標記。因此,它們可能鼓勵患者採取預防性措施,類似於涉及乳腺癌風險的BRCA1基因可能影響癌症風險極高的患者採取預防性手術的方式。
Wei的研究迄今為止把重點放在了對細胞培養和小鼠的研究上,他的研究將繼續採取更多的措施去理解DNA損傷如何誘導了p53修復路徑。他的研究再加上哈佛大學醫學院系統生物學系的共同作者GalitLahav近來的發現,也表明了在DNA修復期間細胞顯示出了規則的p53漲落脈衝,Wei希望更好地理解它。“這並非p53的濃度高或者低。細胞的動態總是在變化,”Wei說。
