定義
脫鹵反應也稱為 β-消除反應,是消除反應的一種。
在脫鹵反應中,鹵烷上的鹵素和β-碳上的氫原子反應,形成鹵化氫。而α-碳和β-碳之間的鍵結改為雙鍵,因此形成烯類。查依采夫規則可以解釋此反應的區域選擇性。脫鹵反應的逆反應是氫鹵化反應。
反應機理
E1消除反應
單分子消除反應(E1反應,E代表Elimination) 反應物先電離,離去基團斷裂下來,同時生成一個碳正離子,然後失去β氫原子並生成π 鍵。反應分兩步進行,決定速率這一步(決速步)只有反應物分子參加。故E1的速率與反應物的濃度成正比,與鹼的濃度無關。單分子消除反應,而1代表反應速率只受其中一個化合物濃度的影響),由於反應的速率控制步驟只與一個底物分子有關,是單分子過程,在反應動力學上是一級反應,故稱為“單分子消除反應”。
 脫鹵反應
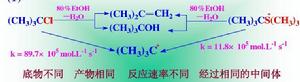
脫鹵反應單分子消除反應機理:
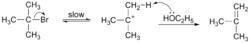
第一步是底物分子的離去基團離去,生成中間體碳正離子,這一步較慢;
第二步是溶劑分子奪取碳正離子β-氫,生成烯烴。由於反應的速率控制步驟只與一個底物分子有關,是單分子過程,在反應動力學上是一級反應。
 脫鹵反應
脫鹵反應影響因素
影響消除反應的因素是烷基的結構、試劑的鹼性、溶劑的極性以及反應的溫度。單分子消除反應中,試劑進攻的是外圍β-氫原子,所受空間阻礙小於進攻α-碳原子,因此鹵代燒發生消除反應活性次序是3°RX>2°RX>1°RX; 增加試劑的鹼性有利於奪取β-氫原子,發生消除反應;增加溶劑的極性利於取代,不利於消除;升髙溫度對取代和消除都有利,但更有利於消除,因為消除需拉斷C—H鍵,比取代吸熱更多。
綜上所述,髙溫、強鹼和弱極性溶劑有利於消除反應。
E2消除反應
雙分子消除反應(又名E2反應,E代表Elimination,而2代表反應速率受到二個化合物濃度的影響),為消除反應的一項反應機構,由於反應為一步形成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反應。
基本性質
1、E2反應不需侵入重圍,攻擊之中的碳原子,只需從旁拉走一個質子,因此立體阻礙在此並不如SN2反應般發生影響,因此在一、二、三級受質皆可發生反應,而因為E2反應不會產生碳陽離子,故不會發生重排現象。
2、雙分子消除反應與單分子消除反應和單分子親核取代反應互為競爭反應。但由於E1反應較難發生,所有條件都必須恰到好處,(三級受質、弱鹼、極好的離去基),如果三個條件有一樣稍微不同,反應都較傾向於遵循E2反應機構。
3、E2反應為一步反應,因此應鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反,但離去基的影響相較於E1反應並沒有如此敏感,但是離去基越強,皆能增加E1及E2的反應速率。
雙分子消除反應如同SN2反應,反應由一步完成,但不同的是由鹼來拉走質子,而並不是當作親核試劑,鹼進攻β-氫,並與離去基同時離去,生成烯烴。而由於反應為一步完成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。
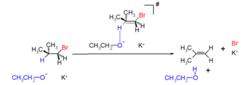 脫鹵反應
脫鹵反應上圖乙醇作為鹼攻擊β-氫,溴帶著共用電子對在離去基作用下離去,而氫以質子的方式離去。
知識擴展
共軛鹼單分子消除反應
反應物先與鹼作用,失去β氫原子,生成反應物的共軛鹼碳負離子,然後從這個碳負離子失去離去基團並生成π鍵。在生成π鍵的步驟中只有共軛鹼碳負離子參加。
共軛鹼單分子消除反應(E1CB)也分兩步進行,反應速率不僅與反應物濃度成正比,也與鹼的濃度有關,其關係較複雜,在多數情況下也成正比。一般說來,只有β碳原子上連有硝基、羰基或氰基等足以穩定碳負離子的強吸電子基團的反應物,才能按E1CB機理進行反應。
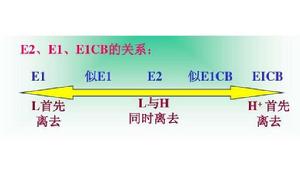
三者的關係:
 脫鹵反應
脫鹵反應決定因素
(1)底物:有利於形成穩定碳正離子的底物傾向於E1;若帶有穩定碳負離子的官能團,傾向於E1cB;
(2)鹼:鹼越強,濃度越大,越有利於E1cB,E2機理;
(3)離去基團:越易離去,越容易發生E1;
(4)溶劑:極性強的溶劑,有利於E1和E1cB;極性弱則有利於E2;