簡述
膠體因電位降低或消除,從而失去穩定性的過程稱為脫穩(Destabilization)。脫穩的膠粒相互聚集為微絮粒的過程稱為凝聚。不同的化學藥劑能使膠體以不同的方式脫穩和凝聚。
分類
按機理,脫穩和凝聚可分為壓縮雙電層、電性中和、吸附橋連和網羅卷帶4種。
壓縮雙電層
壓縮雙電層(Electronic Double-layer Compression)是指在膠體分散系中投加能產生高價反離子的活性電解質,通過增大溶液中的反離子強度來減小擴散層厚度,從而使電位降低的過程。該過程的實質是新增的反離子與擴散層內原有反離子之間的靜電斥力把原有反離子程度不同地擠壓到吸附層中,從而使擴散層減薄。
如果從膠體間相互作用勢能的角度進行分析,那末在膠粒間存在靜電斥力的同時,總是存在著范德華引力,兩種力的作用強度可分別用排斥勢能和吸引勢能來表述。膠體的視在穩定性就取決於上述兩種勢能中何者占主導地位。
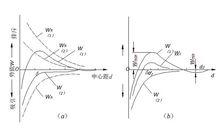 脫穩
脫穩理論分析說明,排斥勢能和吸引勢能都隨與膠粒中心距的縮小而增大,不同的是吸引勢能的變化幅度要比排斥勢能陡峭,而且與溶液中的反離子強度無關,而排斥勢能則能與反離子強度緊密相關。因此,對一種特定膠體只有一種吸引勢能曲線,但隨反離子強度的不同而有多種排斥勢能曲線。將排斥勢能和吸引勢能疊加,可得作用於粒子上的總勢能W。膠粒間作用勢能與中心距的關係可用圖4-2所示的勢能曲線表述。圖中,表示低反離子強度下的高排斥勢能曲線,表示高反離子強度下的低排斥勢能曲線。如果對和進行幾何疊加,可繪出相應的綜合勢能曲線和。由圖可見,在範圍內,W(1)曲線位於橫軸上方,並在d=d1處出現一個極大值;隨著值的增大,又逐漸變為負值,並在d=d2處出現一個極大值,最後趨近於零。W(2)曲線則隨d值由大變小而連續增大,並始終處於橫軸下方。上述曲線上的極大值稱為勢能峰或勢能壘,可看作膠粒接觸碰撞所必須克服的“活化能”,只有將它降低到小於膠粒的動能時,膠粒之間才能發生碰撞和凝聚。在穩定的膠體分散系中,膠粒的動能主要來自布朗運動,其值不過1.5kT(k為波爾茲曼常數,k=1.38×10J/K,T為絕對溫度,(K),)而勢能峰卻高達數百以至數千kT,因而膠粒始終不能超越勢能峰的阻礙而發生凝聚。但是,如果向體系中投加電解質來壓縮雙電層,使電位由降低至曲線由降低至。此時曲線上的值依次減小並向左移動。當由降低至時,膠粒開始脫穩;當=0時,勢能峰消失,W曲線進一步降低至在所有值範圍內W都占主導的W(2),膠粒的每次碰撞都促成聚集,膠體分散系便達到了快速凝聚狀態。
電性中和
當投加的電解質為鐵鹽、鋁鹽時,它們能在一定條件下離解和水解,生成各種絡離子,如[Al(HO)]、[Al(OH)(HO)]、[Al(OH)(HO)]和[Al(OH)(HO)]等。這些絡離子不但能壓縮雙電層,而且能夠通過膠核外圍的反離子層進入固液界面,並中和電位離子所帶電荷,使電位降低,電位也隨之減小,達到膠粒的脫穩和凝聚,這就是電性中和(Charge Neutralization)。顯然,其結果與壓縮雙電層相同,但作用機理是不同的。
吸附橋聯
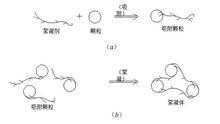 脫穩
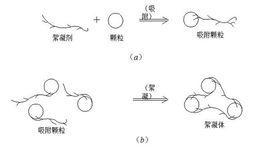
脫穩如果投加的藥劑是水溶性鏈狀高分子聚合物並具有能與膠粒和細微懸浮物發生吸附的活性部位,那么它就能通過靜電引力、范德華引力和氫鍵力等,將微粒搭橋聯結為一個個絮凝體(俗稱礬花)。這種作用就稱為吸附橋聯(Adsorption Bridging)。聚合物的鏈狀分子在其中起了橋樑和紐帶的作用。
吸附橋樑的凝聚模式如右圖。顯然,在吸附橋聯形成絮凝體的過程中,膠粒和細微懸浮物並不一定要脫穩,也無需直接接觸,電位的大小也不起決定作用。但聚合物的加入量及攪抖強度和攪拌時間必須嚴格控制,如果加入量過多,一開始微粒就被若干個高分子鏈包圍,微粒再沒有空白部位去吸附其它的高分子鏈,結果形成了無吸附部位的穩定顆粒。如果攪拌強度過大或時間過長,橋聯就會斷裂,絮凝體破碎,並形成二次吸附再穩顆粒。
網羅卷帶
網羅卷帶也稱網捕(Sweep Flocculation)。當用鐵、鋁鹽等高價金屬鹽類作混凝劑,而且其投加量和介質條件足以使它們迅速生成難溶性氫氧化物時,沉澱就能把膠粒或細微懸浮物作為晶核或吸附質而將其一起除去。