細菌的遺傳重組
遺傳物質在細菌中有三種轉移的形式,即轉化、接合和轉導。這三種轉移形式的共同特點是:單方向轉移;都產生部分二倍體(partial);基因只有整合到環狀染色體上才能穩定的遺傳。
轉化
轉化是通過外源的DNA片段傳遞遺傳信息的過程。此外源DNA片段一般都是人工抽提的,傳遞時不需要載體,而是利用改變細胞膜的通透性,使外源DNA片段進入細胞,整合到基因組中,改變基因型。在細菌中,轉化是非病毒DNA導入細胞的過程。轉染是轉化的一種特殊形式,用於原核細胞時其外源DNA是特指離體的噬菌體DNA,來感染感受態的細菌,並在其中得到表達。用於真核細胞時,對任何裸露DNA的吸收都稱為轉染。
細菌轉化的現象是在1928年被F.Griffth首先發現的。1944年O.Avery及其同事確定細菌轉化因子是DNA。在轉化中游離DNA的片段被活的細菌所接受。而導致部分後代遺傳性狀發生了穩定的改變。轉移過程通常用來進行製作細菌的基因圖,這種作圖方法是接合和轉導所不能取代的。在轉化作圖的實驗中,從一個供體品系的細胞中抽提和純化DNA,然後將它斷裂成小的雙鏈片段,再加入到不同基因型的受體細菌的懸浮液中。被受體細胞接受的供體DNA片段就可以和受體染色體的同源部分進行重組,產生重組染色體,由於基因的重組導致了受體表型發生了改變,這個過程就稱為轉化。在轉化中,任何品系都可以作為供體或受體,但供體和受體的基因型應是不同的。
大部分種類的細菌都可以通過轉化而重組。但變異的關鍵在於它們吸收供體DNA的能力。有的細菌如枯草桿菌(Bacillus subtilis)在試管中能很容易被轉化,可用這種方法來作圖。但野生型E.coli並不容易轉化,這是由於細菌產生一種酶能迅速降解進入的外源DNA,經過多年的努力,科學家們發現了一種方法可以增加細胞吸收外源DNA的效率。那就是用化學方法處理細胞,使其改變膜對DNA的通透。這種細胞就稱為感受態細胞(competent cells),即細胞處於能攝取核酸分子時的生理狀態。這種方法已經成為基因工程的常規技術,它對於我們利用體外DNA重組技術來了解真核和原核生物的基因功能特別重要。
細菌的轉化有兩種類型:一種是自然轉化(natural transformation),在自然轉化中細菌可以自由地吸收DNA,通過它來進行遺傳轉化;另一種是工程轉化(engineered transformation),在這種轉化中,細菌發生改變使得它們能攝入並轉化外源DNA。枯草桿菌中的轉化就屬於自然轉化,E.coli轉化屬於工程轉化。
在轉化實驗中,並非所有的受體細胞都被轉化了,實際上只有很少比例的細菌吸收了外源DNA,一旦供體DNA被受體攝取,我們是可以檢測到重組的轉化產物和受體細胞的染色體。讓我們來看一下枯草桿菌轉化的例子。
受體染色體上有一個突變基因a,而供體的雙鏈片段上有其野生型等位基因a+;外源DNA雙鏈一條被降解,僅一條被攝入受體細胞;這條單鏈線狀DNA片段和受體的環狀染色體的同源部分形成了三鏈結構;供體的單鏈DNA和受體雙鏈DNA通過雙交換進行重組;結果在雙交換區域內,受體染色體發生重組,形成雜合雙鏈a/a +,帶有供體的a+基因,而被取代的單鏈上卻帶有受體的等位基因a,後被降解;經複製後產生了兩種不同的後代,一種是a+/a+,另一種是a/a,預計各站2一半。貴恙於高度感受態的受體細胞用過量的外源DNA片段進行轉化,轉化的頻率約為10-3,即103個細胞中約有一個被轉化。
轉化過程可分為幾個步驟:
(1)雙鏈DNA分子和細胞表面感受位點可逆性的結合;
(2)供體DNA片段被吸入受體細胞;
(3)侵入受體細胞的供體雙鏈DNA轉變成單鏈形式,其中的一條鏈被降解;
(4)未被降解的一條鏈部分或 整個插入受體細胞的DNA 鏈,形成雜合的DNA分子;
(5)雜合DNA複製後,形成 一個親代類型的DNA和一個 重組類型的DNA並導致轉化 細胞的形成與表達
通過轉化可以測定基因的連鎖、基因的排列順序以及圖距。原理如下:如果在供體的染色體上有兩個離得很遠的基因a+和b+,我們將會發現它們總是在不同的DNA片段上,這樣如果有一個a+b+供體和ab受體,那共轉化(contransformation)即兩個基因同時轉化的機率是兩個基因單獨轉化機率的乘積。若每個基因的轉化產生率是10-3的話,那么這兩個基因被同時轉化的頻率是10-6。如果兩個基因離得很近,有可能位於同一個DNA片段上,那么它們共轉化的頻率將接近單個基因轉化的頻率。我們也可以這樣說,若共轉化的頻率要比兩個單個基因轉化頻率乘積高的話。那么這兩個基因一定大緊密連鎖的。
基因的順序也可以通過共轉化的結果來分析確定。,p+和q+常常共轉化,而q+和o+也常常共轉化,但基因p+和o+從未發生共轉化,那么這三個基因的順序一定是pqo。
接合
E.coli接合的發現
1946年萊德伯格(J.Lederberg)和塔特姆(Tatum)發現在細菌之間轉移遺傳物質的另一種方法——接合。細菌接合是指通過細胞的直接接觸,遺傳信息從供體單向轉移到受體的過程。
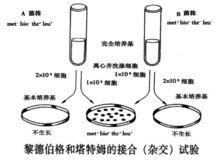 細菌和噬菌體的重組與連鎖
細菌和噬菌體的重組與連鎖在Lederberg發現這種方法以前,人們已經對細菌的雜交進行了探索,但存在兩大難題不易解決。1.a+b-×a-b+-----雜交後得到重組子(a+b+)的頻率很低,和基因回復突變頻率相近,難以區別。也就是說難以確定a+b+是由兩個親本回復突變產生還是真正的重組子。2. E.coli雜交產生重組頻率為10-7,也就是說要檢查千萬個菌落才能發現一個重組菌落,工作量太大。 Lederberg採用了兩個措施便巧妙地解決了這兩個難題。一是使用多重突變型(multiple auxotroph)品系作為親本進行雜交,由於兩個或多個基因在同一親本中同時發生回復突變的頻率很小很小,這樣可一十分信服地將重組子和回復突變區分開。二是採用了以基本培養基來篩選原養型的方法。由於製備多重突變型親本工作量很大,正好在此不久前史丹福大學的Tatun分離出了各種E.coli的生化突變型,於是Lederberg遍邀請了這位曾和比德爾合作建立"一基因一酶"學說的微生物專家合作。巧的是Tatum就在E.coliK12品系中挑選了多重突變型,而正好K12中是有F因子的,這是事前並不知道的,只不過K12是他在教學工作中多年使用的品系。如果當時要是採用了不含F因子的品系,那么實驗那難以成功,至少接合的發現要延遲數年。因此他們的這次合作在科學史上是一樁幸運的事,由於他們的特殊貢獻,1958年Beadlr,Tatum和Lederberg獲得諾貝爾獎。
由於遺傳學家可以控制轉化片段大小,因此兩個基因共轉化的頻率可以和轉化片段的平均大小相等。通過轉化片段平均大小相關的共轉化頻率測定,就可以獲得這些基因的連鎖圖譜。
雖然回復突變的可能排除了,但人們仍提出以下質疑;1.細菌雜交實驗獲得的重組子可能是轉化的億個微度。因為有可能一種親本的細胞在處理過程中發生破裂釋放出轉化因子,和另一親本重組而產生部分的原養型。2.培養基中含有某些代謝產物,混合後這些產物互相補充了對方的足而得以在基本培養基上生長。這兩個問題是尖銳而深入的。為澄清這個問題,萊德伯格和塔特姆將一種親本的培養基經過細菌漏斗過濾,除去細胞,然後再加入另一親本的培養物中,結果未產生原養型。如果雜交實驗中可以產生轉化因子即DNA片段或某些可以互相補充的產物,那么它們是可以通過過濾器進入濾液中,進一步和受體作用,產生原養型,但結果正相反,說明也可以排除以上質疑,並提示A和B品系細菌的直接接觸似乎是出現原養型的必要條件。
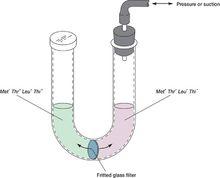 細菌和噬菌體的重組與連鎖
細菌和噬菌體的重組與連鎖1950年戴維斯(B.D.Davis)設計了U形管實驗,進一步支持了上述結論。U形管的底部有一砂芯橫隔,上有微孔,可以通過0.1μm以下的顆粒,細胞無法通過。戴維斯將A、B品系分別放入U形管的兩側,一側塞上棉塞,另一端接上注射器。當兩種細菌培養物都增生到飽和狀態時,用注射器輕輕地把培養液從一臂經過濾器吸到另一臂。再輕輕地壓過去,讓培養液充分混勻,但兩種品系的細胞無法接觸,然後兩側的A、B菌株離心洗滌後塗布到基本培養基上,都不出現菌落,即不產生重組子。若培養液中有轉化因子DNA,或代謝產物的話是可以在兩個品系之間充分交流的,但並未引起重組,因此完全可以排除轉化和代謝產物互相補充的可能性,而清楚的表明,兩個親本的細胞不互相接觸是不能進行雜交的,這為研究接合的本質奠定了基礎。由於歷史的局限,從一開始萊德伯格和塔特姆就根據真核的重組來解釋他們的發現,認為細菌接合是一個彼此交換遺傳物質的過程,即細菌同宗配合(homothalic)。導致1951年萊德伯格根據自己的實驗,將E.coli的連鎖圖繪成三叉戟狀,使E.coli連鎖圖的繪製陷入困境。任何一個偉大的科學家在他整個的一生中難免會出現一些失誤,但他們那種創新的精神,求實的態度永遠值得後人學習和讚美。
單向轉移和F因子
1952年海斯9W.Hayes)的意外發現動搖了"細菌同宗配合"觀點,使細胞接合的研究又轉向正確的方向。
海斯在重複萊德伯格和塔特姆的細菌雜交實驗之前,分別用高劑量的鏈黴素來處理A品系和B品系,結果A品系受處理後,雜交結果不受影響,而B品系受處理後完全阻止了重組的發生。這對海斯來說意味著兩個品系在雜交過程中的作用是不同的,也就是說可能不是互動的過程,而是一個單向的過程。因為鏈黴素可以阻止細胞分裂繼而殺死細胞。大它還允許交配持續一個短時間。A品系在交配後被殺死並不影響雜交結果,表明它是一種供體,像雄性動物一樣,交配後被殺死,不會影響後代。海斯的結論認為細菌的接合是異宗配合(heterothalic)過程,兩個親本在雜交中所起的作用不同,有供體和受體之分,相當於雄性和雌性。
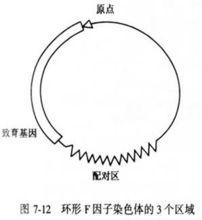 細菌和噬菌體的重組與連鎖
細菌和噬菌體的重組與連鎖Hayes等進一步研究發現,大腸桿菌在接合中作供體的能力受細胞內一種致育因子(fertility factor, F因子; sex factor,性因子)控制。
F因子是細菌中獨立染色體外可複製的質粒,為一環狀DNA,包括原點、配對區和致育基因。F因子上大部分區域叫育性區或育性基因,負責大腸桿菌的育性。含有育性區的大腸桿菌在細胞表面有很多毛狀的性纖毛(或性傘毛)。
A菌株中的F質粒通過配對區可和大腸桿菌染色體的某些區域配對,配對後即可交換,便整合到大腸桿菌染色體上。這種既可以整合又可以游離的質粒叫 附加體。
含有游離狀態的F因子叫F ,沒有的叫F ,含有整合狀態的叫Hfr(高頻重組)。大量混合後,只有F ×F ,Hfr×F 能雜交,而F ×F ,F ×F ,Hfr×Hfr,Hfr×F 都不能雜交。因此大腸桿菌的和相當於高等植物的雌雄配子。
F菌株和 F菌株靠近→細胞膜融合→兩細胞間形成接合管。然後,F因子從原點斷裂,以原點為先導,邊複製邊轉移(因此叫滾環複製),複製後的F因子轉移到另一個細胞中。最後,細胞分開,使F 變成F 。
2.Hfr ×F
F因子可整合在大腸桿菌不同的部位,由於整合的部位不同,方向不同,則形成了不同的Hfr。
在Hfr×F 雜交過程也是先形成接合管,然後Hfr邊複製邊轉移,轉移的順序:原點—配對區—大腸桿菌基因—配對區—育性基因。在轉移過程中,結合管很易破裂,這樣轉移到受體的部分只是靠近原點的一部分(全部轉移需溫和條件120分鐘),形成部分二倍體:一個完整的基因組和一個不完整的基因組所構成的二倍體。在部分二倍體中,受體的基因組叫內基因子,供體的基因組叫外基因子。外基因子轉移到受體以後:游離。隨著細胞分裂代數的增加被稀釋,消失;與內基因子發生交換、重組。奇數交換,形成一個線狀分子,在大腸桿菌中不能複製,導致細胞死亡;偶數交換,形成線狀分子(不能複製,消失)和環狀分子。大腸桿菌複製時,DNA複製酶只能識別環狀分子。其中原點有273bp,富含AT,首先解旋成“眼”狀結構,然後雙向複製。
大腸桿菌的重組與真核生物的不同
(1)基因重組發生在部分二倍體中(自然狀態下很難把供體基因全部轉移過來)
(2)奇數交換無效,偶數交換有效。
(3)只出現一種重組子(雜交後代),真核生物出現四種雜交後代。
(4)在F+×F-中,結果使F-變為F+,很少發生基因重組(供體與受體之間)
因為F+大部分是游離的,不轉移,只有個別的細胞是整合狀態。只有整合的才能轉移,進行基因重組。
(5)在Hfr×F-中,F-很少變成F+,基因重組頻率比較高。雜交後,育性基因沒有轉移。
中斷雜交法定位大腸桿菌的基因
在Hfr×F-過程中,人為的中斷大腸桿菌雜交而進行的基因定位叫中斷雜交法。
中斷雜交的原理
Hfr和F-一混合,形成接合管,然後進行轉移,越接近原點的基因,進入受體就越快。用振盪器振盪使之中斷,檢測受體細胞中的供體基因。1分鐘內出現了受體A基因,則說明A基因很近原點;2分鐘內出現了受體AB基因,則說明B在A之後,也近原點;3分鐘內出現了受體ABC基因,則說明C在AB之後,也近原點;則按時間來定位,標出不同基因位於原點的先後位置,單位:時間單位。據基因進入受體的時間來定位基因(假定轉移是勻速的)。
轉導
普遍性轉導
烈性噬菌體浸染含基因的大腸桿菌,噬菌體DNA進入寄主後環化,水解寄主的染色體,合成的蛋白質外殼誤包裝了寄主的一段DNA,形成含基因轉導噬菌體。當它再浸染含基因的寄主時,在基因的兩端雙交換,使寄主變為。這種轉導供體的任何一個基因都可能被轉移,且幾率相等,因此稱普遍性轉導。
局限性轉導
λ噬菌體吸附在大腸桿菌表面,頭部線狀DNA被注入寄主後,DNA首先環化。 游離狀態的環化DNA複製(滾環型複製)形成許多線狀DNA,然後包裝,最後釋放出新的噬菌體,大腸桿菌被裂解——裂解生長。環化DNA整合在大腸桿菌染色體的兩個基因(bio 和gal)之間,整合狀態的噬菌體叫原噬菌體(或前噬菌體),或叫沒有侵染能力的噬菌體。含有原噬菌體的菌叫溶原化菌。在某些因素作用下原噬菌體還可從大腸桿菌染色體上剔除下來。
λ噬菌體浸染含有bio 和gal 的大腸桿菌,整合,剔除時偏向一端(不正常的剔除),裂解生長包裝,釋放出多個轉導噬菌體(攜帶大腸桿菌基因),再浸染gal 的受體,轉導噬菌體進入寄主後環化,形成部分二倍體,表型gal ,可發酵半乳糖。λ噬菌體DNA游離不整合,噬菌體不能複製,最後消失,但大腸桿菌表型由gal 變為gal ;λ噬菌體DNA整合到大腸桿菌染色體中,表型為gal ,整合的λ噬菌體還可游離出來。 λ噬菌體與大腸桿菌染色體上的gal 基因交換,新的含gal 基因的λ噬菌體不能複製最後消失,大腸桿菌表型為gal 。
提供基因的叫供體,接受基因的叫受體。提供基因的噬菌體為轉導噬菌體,接受了基因的受體叫轉導子。僅能轉移供體的個別的特定的少數的基因(只能轉移整合部位兩側的基因)為局限性,僅能轉移少數特定基因的轉導叫局限性轉導。
轉導的特點
(1)轉導是以噬菌體為介導的;
(2)重組發生在部分二倍體中;
(3)只出現一種重組子,不出現相反的重組子(如gal 消失,只剩下gal )。
噬菌體遺傳分析
噬菌體是指浸染細菌、放線菌以及真菌的病毒。包括溫和、烈性兩種,都沒有細胞結構,由一個蛋白質外殼包圍一段DNA或RNA(菸草花葉病毒為RNA病毒)。
噬菌體的突變型
1.1、快速溶菌突變型:少量T系列噬菌體(如T2)和大量大腸桿菌混合,塗於固體平板,噬菌體裂解速度越快,出現的噬菌斑越大。野生型r+噬菌斑小,快速生長突變型r-噬菌斑大。
1.2、寄主範圍突變型:野生型T2隻能浸染B菌株,不能感染B2菌株(用h+表示);T2突變為T2-,產生抗性突變?,既能浸染B菌株,也能浸染B2菌株(用h-表示)。當在含有B/B2的固體培養基上接種h+後,出現半透明的噬菌斑;而接種h-後,出現透明的噬菌斑。
噬菌體的基因重組
把噬菌體h r 和大量噬菌體h r 加入含有大腸桿菌B的完全培養基。兩種噬菌體混合造成復感染(一個大腸桿菌中同時進入兩種噬菌體)。將大腸桿菌濾下來,收集噬菌體(加氯仿振盪),將少量噬菌體再塗於含有大腸桿菌B和B2菌株的固體培養基中,出現噬菌斑,除預期的半透明大噬菌斑(h+r-浸染造成)和透明小噬菌斑(h r 浸染造成)外,還出現了半透明小噬菌斑和透明大噬菌斑兩種表型。
因為T2噬菌體為烈性噬菌體,當兩種T2噬菌體復感染大腸桿菌B時,不和大腸桿菌染色體整合,而在兩種噬菌體h、r基因之間和一個基因外側發生了雙交換(單交換後形成一個環,不能複製而死掉),結果形成四種噬菌體h+r 、h-r+、h+ r+和h- r-(後兩種為重組類型)。
B菌株B2菌株培養基是鑑別噬菌體性狀的工具(如同解剖鏡是觀察果蠅的工具)。