細胞定義
 細胞色素C
細胞色素C卟啉環以四個配價鍵與鐵原子相連,形成四配位體螯合的絡合物,一般稱為血
紅素。根據血紅素輔基的不同結構,可將細胞色素分為a、b、c和d類。b類細胞色素的輔基是原血紅素即鐵-原卟啉Ⅸ。卟啉環上的側鏈取代基為4 個甲基,兩個乙烯基和兩個丙酸基與血紅蛋白、肌紅蛋白輔基的結構相同。
a 類細胞色素輔基的結構是血紅素A,它與原血紅素的不同是在於卟啉環的第八位上以甲醯基代替甲基,第二位上以羥代法呢烯基代替乙烯基。
d類細胞色素僅在細菌中發現,它的輔基為鐵二氫卟啉,與其他細胞色素不同。
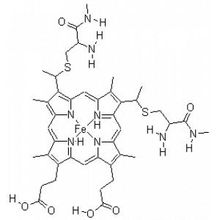
c類細胞色素的輔基是血紅素以其卟啉環上的乙烯基與蛋白質分子中的半胱氨酸巰基相加成的硫醚鍵共價結合(見圖)。其他各類細胞色素的輔基都是以非共價鍵與蛋白相結合。還原狀態的細胞色素在可見光區具有特徵性的光吸收帶:α帶、β帶、γ帶(或稱吸收帶)。通常a類細胞色素的α吸收帶位於598~605納米;b類的最大α吸收帶在556~564納米;c類在550~555納米;d類為600~620納米之間
歷史背景
Macmunn首先在1886年,在動物細胞中發現一種含血紅素的色素,取名為組織血紅素。但當時的主要生物化學家認為是一種實驗錯誤。直到1925年Keilin證實了Macmunn的發現,並改名為細胞色素。
特徵和分布特點
真核細胞
真核細胞(動物、植物、酵母、脈孢菌)的線粒體膜和某些細菌的細胞質膜上的氧化磷酸化電子傳遞鏈中,細胞色素包括:Cyt a、Cyt a3、Cyt b、Cyt c、Cyt c1,除Cyt c外其他都是緊密結合線上粒體內膜上,Cyt c1因呈現水溶性,故與線粒體內我結合不緊密。它們的氧化還原電位(電子親和性)逐漸增加,其作用是將電子從各種脫氫酶系統順序地傳遞到分子氧。其中除了細胞色素c是膜的外周蛋白,位於線粒體內膜的外側,能被鹽溶液抽提以外,其他的細胞色素都緊緊地與線粒體內膜相結合,需要高濃度的去垢劑才能把它們增溶下來。由於細胞色素c是一種可溶性的蛋白,易於獲得結晶,因而它是電子載體蛋白中結構研究得最清楚的。
動物細胞
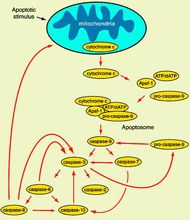 細胞色素釋放引起的凋亡
細胞色素釋放引起的凋亡高等動物的細胞色素c由104個胺基酸殘基的一條肽鏈組成;分子量約為13000,在
共價結合的血紅素輔基中;鐵原子的第5、6個配位鍵被組氨酸咪唑基的氮原子和甲硫氨酸的硫原子所占據,因而還原型的細胞色素c不能被氧直接氧化。它催化電子從細胞色素還原酶(或稱bc1複合物) 傳遞到細胞色素氧化酶(或稱細胞色素aa3)。已對80多種不同種屬的細胞色素c進行了一級結構測定,並根據其胺基酸變異數繪製了種屬發生圖,這不僅揭示了細胞色素c在進化上來自一個共同的祖先,也可以據此估計生物的主要種屬發生進化的可能時間。細胞色素b和c1是輔酶Q-細胞色素c還原體系中的兩個帶氧化還原中心的組分。細胞色素b是一個橫貫膜兩側的極端疏水性的蛋白。對細胞色素b胺基酸組成和結構基因的脫氧核糖核酸(DNA)順序研究指出,約68%的胺基酸為非極性的。對細胞色素b在電子傳遞鏈中的複雜功能至今還不清楚。細胞色素c1的多肽由一個大的親水部分和一個小的疏水部分組成,親水區帶有血紅素輔基伸出在膜外的水相中,與細胞色素c有一個結合點。細胞色素a、a3也稱細胞色素氧化酶,它的功能是催化還原的細胞色素c為氧分子所氧化。在化學結構上,血紅素a和a3具有一致性。近年來的研究指出,可能血紅素a和a3結合於不同的蛋白亞基上。血紅素a3與細胞色素b、c1、c和a不同,a3卟啉環中鐵原子的第6個配位鍵並沒有被胺基酸殘基所占據。因此,它在還原態時(Fe2+)能與氧和一氧化碳直接結合,在氧化態時能與HCN、HN3和啹S等結合。在這些物質中氧是細胞色素氧化酶的底物,其他都是它的抑制劑。氰化物的劇烈毒性就是由於它對細胞色素氧化酶的強烈抑制從而阻斷了生物體的呼吸作用。
植物細胞
在植物和一些藻類的光合電子鏈中,至少有三種細胞色素參與光誘導的光合電子傳遞,起電子載體的作用:細胞色素b6(或稱細胞色素b563)、細胞色素b3(或稱細胞色素b559)和細胞色素f(或稱細胞色素b552)。細胞色素f最早是在葉子中發現的,結構上屬於c類細胞色素,分子量約為100000,其α吸收峰位於552~555納米之間。細胞色素b3、b6、f 都是不對稱地分布於葉綠體類囊體的膜上,與膜緊密結合的膜蛋白。光合細菌,如紫色非硫細菌或綠色光合菌如處於無光照並給予氧氣的條件下,它們的電子傳遞鏈十分相似於線粒體的呼吸鏈;如處於光照及厭氧條件下,其電子傳遞鏈由輔酶Q-細胞色素c2氧化酶組成。細胞色素c2是一個水溶性的細胞色素,分子量為12000~14000。它的一級結構與哺乳類線粒體中的細胞色素c十分相似,並具有c的典型的吸收光譜,α最大吸收峰為550納米。
非磷酸化的電子傳遞酶系
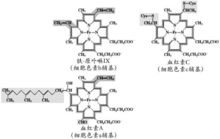 細胞色素輔基
細胞色素輔基除了氧化磷酸化和光合磷酸化的電子傳遞鏈以外,細胞色素還存在於非磷酸化的電子傳遞酶系中。在動物組織的細胞器內質網系膜和微生物中,廣泛存在著兩種重要的細胞色素:細
胞色素b5和細胞色素P-450,催化一些脂溶性的底物的羥化、去飽和及氧合等反應。微粒體細胞色素b5是NADH-△9硬脂醯輔酶A去飽和酶系中的一個組分。分子量約為16000,是一個兩性的膜蛋白:N端親水的催化區由約80個胺基酸殘基組成;C端的疏水肽約由40個左右胺基酸組成,起了與膜的疏水內部結合的作用。b5從NADH-細胞色素b5還原酶(黃素蛋白) 接受電子後,傳遞給硬脂醯輔酶A去飽和酶,使硬脂酸在△9位去飽和,生成油酸。P-450也是一種b類細胞色素,輔基為原血紅素Ⅸ。它的特點是在還原狀態時能與一氧化碳結合,在450納米處呈現吸收峰因而得名。在肝臟微粒體中,存在有5~6種不同的P-450參與一些脂類物質的代謝(如類固醇、脂肪酸、前列腺素),也催化一些外來物質如藥物毒物等的氧化代謝(解毒)。P-450 的作用機制可能是通過輔基中Fe2+與氧分子結合而形成Fe2+·O2,再接受電子引起氧-氧鍵的裂解,一個氧原子與質子形成水,另一個氧原子被激活而插入到底物的C-H鍵中,使底物羥化。通過此類反應可以引起這些外來有毒物質的一系列代謝反應,最終導致這些物質排出體外。但是有時某些相對無毒或低毒物質的羥化產物反而具有劇毒,例如多環芳烴的羥化產物即是強烈的致癌物質。
注意事項
1、在呼吸鏈中細胞色素屬電子傳遞,而非遞氫體;
2、在呼吸鏈中,它們的排列順序為Cyt b,Cyt c1,Cyt c,Cyt aa3;
3、Cyt a與Cyt a3形成複合體Cyt aa3,其負責將電子從Cyt c傳遞給氧,故稱為細胞色素氧化酶(細胞色素C氧化酶)。
細胞色素分族
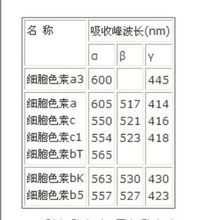 動物體內各種細胞色素的光譜
動物體內各種細胞色素的光譜所有需氧生物,不論是細菌或高等動物甚至是人都存在有細胞色素,所有細胞色素在可見光區域都有三個吸收峰,分別稱為α、β、γ峰,見表1。各種還原型細胞色素的β峰及γ峰的波長都比較接近,唯有α峰的波長有較大的差別。根據α峰波長的不同,可將動物體內的細胞色素分成a、b、c三族,a族包括a,a3,b族包括bK,bT,b5,P4等, c族包括c,c1。
除細胞色素b及細胞色素P450主要存在於內質網外,動物細胞的細胞色素都存在於線粒體內膜的蛋白質與脂類複合物中。用水提取只能得到細胞色素c,而其他細胞色素仍然固著線上粒體的不溶性顆粒物質上。
鐵卟啉輔基
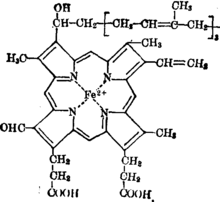 圖1血紅素A結構
圖1血紅素A結構細胞色素都含有鐵卟啉輔基,細胞色素a及a3的輔基是血紅素A (圖1),血紅素A與多肽鏈的結合是非共價鍵。細胞色素bT,bK,b5,P450,c和c1的輔基都是血紅素(圖2),除細胞色素c及c1以外,其他細胞色素的輔基與多肽鏈結合都是非共價鍵結合。細胞色素c中的血紅素通過卟啉環上的乙烯基的α碳和酶蛋白多肽鏈的14,17位半胱胺基酸殘基的-SH連線成硫醚鍵(見圖2)。
除細胞色素a3及P450外,其餘細胞色素中的鐵原子所能形成的六個配位鍵都已被卟啉環中的4個N原子及多肽鏈的18位的組胺基酸的咪唑氮及80位的蛋氨酸殘基的硫原子飽和(見圖2),所以不能再與其他配基結合,唯有a3及P450第六個配位鍵沒有被占據,所以能與其他配基如O2,CN-,CO等結合。
細胞色素氧化酶
已斷定有兩種組分,即a及a3,但不能將兩者分開。實際上a和a3結合成一個大分子的寡聚體,但亞基的數量及結構還不清楚,通常稱為細胞色素aa3或稱細胞色素氧化酶,分子量約為200 000,含有二分子血紅素A及二個銅原子。二個血紅素A與一些配基的反應性有所差別,氧化型a3的血紅素A極易與CN-結合,並且不能再被還原。還原型a3的血紅素A極易與CO生成穩定的複合物,從而中斷呼吸鏈的電子傳遞,而細胞色素a的血紅素A則不能與CO和CN-結合,也不能與O2結合。
細胞色素c族
有c及c1都是線粒體細胞色素,二者的光譜性質十分近似,二者的輔基和與酶蛋白的聯接方式都相同。c1單體分子量為38 000,c1是以多聚體存在,無論是單體還是多聚體,都不能與aa3起反應。細胞色素c是分子量最小的細胞色素,由於它的分子量小,是可溶的,容易提取純化,所以研究比較多,對其結構也最清楚,已測定50多種生物的細胞色素c的一級結構,對它的高級結構也進行過詳細研究。脊椎動物的細胞色素c由104個殘基組成。植物的細胞色素c由112個殘基組成。人及黑猩猩的細胞色素c完全一樣,儘管各種生物的細胞色素c的殘基有許多變化。但其立體結構則基本一致。
細胞色素b族
包括bT、bK、b5、P450等,bT、bK存在於線粒體內膜,是線粒體呼吸鏈的成分,不能與O2結合。b5及P450主要存在於內質網,是微粒體混合功能氧化酶系的組成成分(見“微粒體氧化”條),還原型P450與CO結合後,在450nm有最大吸收峰(γ峰),故取名細胞色素P450,它能與O2結合。