物理性質
白色至黃色晶體。具有反螢石結構。比重1.66(水=1),熔點938℃,沸點1372℃。易溶於水,可溶於乙醇,溶於酸,不溶於鹼 。
化學性質
在空氣中易吸收水蒸氣發生水解,放出劇毒硫化氫氣體。可被酸分解放出硫化氫;可與硝酸劇烈反應,但氫溴酸與氫碘酸只有在加熱的情況下才能將其分解。與濃硫酸反應很緩慢,但同稀硫酸劇烈反應。在空氣中加熱至約300℃時被氧氣氧化,但不生成二氧化硫,而是生成硫酸鋰。
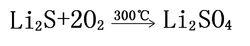 硫化鋰
硫化鋰硫化鋰與酸反應的離子方程式:
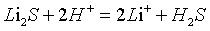 硫化鋰
硫化鋰分子結構數據
1、摩爾折射率:無可用的
2、摩爾體積(cm /mol):無可用的
3、等張比容(90.2K):無可用的
4、表面張力(dyne/cm):無可用的
5、介電常數:無可用的
6、極化率(10-24cm ):無可用的
7、單一同位素質量:46.004078 Da
8、標稱質量:46 Da
9、平均質量:45.947 Da
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:1
3、氫鍵受體數量:1
4、可鏇轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:1
7、重原子數量:3
8、表面電荷:1
9、複雜度:2.8
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3
製取
硫化鋰可通過多種方法製取。過去曾用鋰與硫單質共同加熱進行反應,以及在加熱條件下用碳或氫氣還原硫酸鋰的方法來製取硫化鋰。後來發現鋰與硫在液氨中作用,或乙氧基鋰分解硫氫化鋰的乙醇加合物都可以製得硫化鋰。此後有人用戊氧基鋰與硫化氫反應先製得硫氫化鋰,再使硫氫化鋰在真空加熱分解來製備硫化鋰。
高質量的無水硫化鋰可通過在四氫呋喃中令金屬鋰與硫化氫反應而製得。
貯存方法
常溫密閉避光,通風乾燥處 。
主要用途
可作為可充電鋰離子電池中的潛在電解質材料。
毒理學數據
主要的刺激性影響:
在皮膚上面:刺激皮膚和黏膜。
在眼睛上面:刺激的影響。
致敏作用:沒有已知的敏化現象。
生態學數據
通常對水體是稍微有害的,不要將未稀釋或大量產品接觸地下水,水道或污水系統,未經政府許可勿將材料排入周圍環境 。

