性質
物化性質
 硝酸鉍
硝酸鉍硝酸鉍為無色或白色有硝酸氣味的固體,易潮解,易溶於硝酸、甘油、乙二醇、丙酮、稀酸,不溶於乙醇、四氯化碳、醋酸乙酯。
遇水則分解變成鹼式硝酸鉍,其分子式為Bi(NO)·5HO ,不含結晶水的硝酸鉍尚未製得。
硝酸鉍的性質和硝酸汞十分相似,都能產生鹼式鹽沉澱,單質的化學性質都不活潑,都易潮解等等。
硝酸鉍在加熱下受熱分解:Bi(NO)·5HO在50~60℃分解為鹼式鹽(BiO)(NO)(OH)·6HO,在77~130℃繼續分解為[BiO](NO)·3HO,最終在400~500℃完全脫去水和氮變成α-BiO。(鹼式硝酸鉍溶於稀鹽酸和硝酸,不溶於水和乙醇,稍有吸濕性。當加熱至赤熱時分解成三氧化二鉍和氮氧化物。)
和硝酸汞相似的,當把硝酸鉍晶體溶於水時會產生不溶於水的鹼式鹽沉澱,它的濃硝酸溶液被稀釋時亦是如此。生成的鹼式鹽有:BiONO、BiO(OH)NO和BiO(OH)(NO)·HO。當鹼式鹽沉澱時,溶液中仍然存有[BiO(OH)]。
硝酸鉍可以被強還原劑還原為單質鉍,如亞錫酸鈉作用於硝酸鉍:
3 Na[Sn(OH)] + 2 Bi(NO) + 6 NaOH = 2 Bi↓ + 3 Na[Sn(OH)] + 6 NaCl。
該反應在鹼性條件下進行,產生黑色的金屬鉍沉澱。該反應可以用來鑑定Sn和Bi。
穩定性
1、穩定性:穩定。
2、禁配物:還原劑、易燃或可燃物、活性金屬粉末、硫、磷。
3、避免接觸的條件:潮濕空氣。
4、聚合危害:不聚合。
5、分解產物:氮氧化物。
製備
(1)用硝酸溶解氧化鉍,化學方程式如下:
6HNO+BiO=2Bi(NO)+3HO
(2)硝酸鉍也能有鉍和稀硝酸反應,蒸髮結晶製得,化學方程式如下:
Bi+4HNO=Bi(NO)+NO↑+2HO
(3)反應時用濃硝酸則有可能產生氧化鉍(III),化學方程式如下:
2Bi+2HNO=BiO+2NO↑+ HO
用途
(1)硝酸鉍是一種催化劑,可以和活性炭催化水合肼還原芳香族硝基化合物,來製備芳胺,其產率在78~99%之間;
(2)化學分析中用作化學試劑,用於生產其他鉍鹽和作為醫藥品的原料;
(3)常用於顯像管、發光漆、陶瓷彩釉以及金屬表面前處理。
此外,鹼式鹽(BiO)(NO)(OH)·6HO用途如下:
鹼式鹽則被當作藥物。口服後在胃黏膜創面形成一層保護膜,減輕食物對胃黏膜的刺激;在腸內鉍與硫化氫結合,在腸黏膜上形成不溶解的硫化鉍,使腸蠕動減慢;具有收斂、保護胃黏膜及抗菌作用。可由硝酸鉍部分水解,經過濾,濃縮,冷卻結晶,固液分離,乾燥製得。
貯存方法
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。包裝密封,應與易(可)燃物、還原劑等分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:9
4、可鏇轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:189
7、重原子數量:13
8、表面電荷:0
9、複雜度:18.8
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:4
相關拓展
物化性質
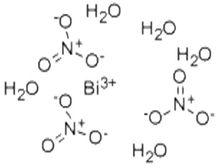 五水合硝酸鉍
五水合硝酸鉍五水合硝酸鉍(Bismuth nitrate pentahydrate)是硝酸鉍遇水形成的鹼式化合物,其分子式為Bi(NO)·5HO。無色有光澤的結晶,有硝酸氣味。易吸濕,呈酸性反應,於80℃失去全部結晶水。密度為2.83g/mL(25℃), 熔點為 30℃(分解),沸點(常壓)為80℃。溶於含有硝酸的水中,在水中分解成次硝酸鉍;溶於甘油、丙酮、稀酸(包括乙酸),幾乎不溶於乙醇和乙酸乙酯。
合成方法
1、將氧化鉍加入盛有蒸餾水的反應器中,緩慢加人濃硝酸進行反應,把反應完成溶液經蒸發濃縮、冷卻結晶、離心分離,製得五水硝酸鉍。其反應方程式如下:
6HNO+BiO+2HO=2Bi(NO)·5HO
2、取分析純硝酸,用水稀釋形成溶液。加熱至60~70℃後,逐漸加入顆粒狀金屬鉍。待反應完畢後,過濾。重複上述步驟直至所有的金屬鉍溶解。將上述過程得到的濾液混合,蒸發至相對密度為1.9。冷卻結晶,再吸濾,於40~50℃乾燥,即得純品硝酸鉍。
3、將20g金屬鉍一點一點地加入40mL濃硝酸(68%)中,使其溶解,然後水浴加熱濃縮至溶液呈淡黃色。冷卻結晶。抽濾,用冷的濃硝酸洗滌。夾在濾紙間乾燥。
4、將密度為1.4的分析純硝酸,用純水稀釋一倍,加熱至60~70℃,逐漸加入適量金屬鉍,進行反應:
Bi+4HNO=Bi(NO)+NO↑+2HO
 硝酸鉍
硝酸鉍反應結束後,過濾,未溶金屬鉍再用上述硝酸溶液溶解,在60~70℃下繼續反應至差不多全部溶解,與上述濾液合併,在60~70℃下蒸發至密度為1.9時,攪拌,用冰冷卻結晶、過濾、甩乾,在40~45℃下乾燥一會兒即可。若含有較多鐵雜質,則應先加水,用硝酸調pH值為1~2,沉澱出次硝酸鉍,使離子留在水溶液中,然後用硝酸溶解沉澱,再蒸發濃縮、結晶、乾燥。
用途
1、用於製造其他鉍鹽,生物鹼的沉澱。制各種催化劑原料、發光油漆、搪瓷。用於製造其他鉍鹽、顯像管和發光漆等。
2、分析試劑,用於鈉和鉈的微量分析,還用於鉍鹽的製造及有光漆和瓷漆的製造。