矽質耐火材料簡介
矽質製品屬酸性耐火材料,對酸性妒渣抵抗能力強,但易被鹼性熔渣強烈侵蝕,易受氧化鉀、氧化鈉等氧化物作用而破壞,但對氧化亞鐵、氧化鐵等氧化物有良好的抵抗性。矽質製品中的典型產品矽磚具有荷重變形溫度高的特點,其荷重軟化溫度接近磷石英、方石英的熔點(1670℃,1713℃);矽磚砌築體有良好的氣密性和結構強度,最大的缺點是抗熱震穩定性低。矽磚主要用於焦爐、玻璃熔窯、酸性煉鋼爐及其他熱工設備的結構材料。
矽質耐火材料原料
製造矽磚用原料包括主要原料、結合劑和礦化劑等。矽磚的主要原料是石英。自然界中有許多石英品種,從結晶狀態看有隱晶的火石到理想晶體的水晶等,耐火材料中這兩個極端品種都不適應,原因是煅燒過程中低溫型石英向各種高溫型晶型轉變時或出現瞬間轉化(如火石),或轉化特別緩慢(如水晶),最適宜於製造矽磚耐火材料的是膠黏石英岩或塊狀石英岩。此外,矽磚生產過程中產生的燒成廢品也可作為原料使用,這可以減少磚坯的燒成膨脹,減少燒成廢品。但加入廢磚會降低製品的耐火度和機械強度、增加氣孔率,因此,廢磚加入量通常控制在20%以下。
矽磚製造中的結合劑有石灰和有機結合劑。石灰以石灰乳的形式加入坯料中,結合磚坯內的石英顆粒,在乾燥後增加磚坯的強度。最常用的有機結合劑是亞硫酸紙漿廢液,其作用是提高坯料可塑性和磚坯乾燥後的強度。石灰的另一個作用是在燒成過程中起礦化劑作用,促進石英的轉變,此外,也有採用軋鋼皮(鐵磷)、平爐渣、硫酸渣、軟錳礦等礦化劑的。
矽質耐火材料製備工藝
矽磚生產的工藝流程大體可分為原料的組成選擇、成形、燒成及冷卻四個主要過程。
矽磚要求的粒度一般是大於1mm的顆粒占30%~35%,0.09~1mm的顆粒占35%~40%,餘下的小於0.09mm。矽質坯體加熱時的鬆散與燒結能力取決於顆粒組成中粗細兩種粒度的性質和數量,粗顆粒轉變在很大程度上發生在細顆粒轉變和矽體開始燒成之後。所以粗顆粒轉變時體積膨脹是磚體趨於鬆散以至開裂的基本因素。相反,細顆粒多處於顆粒堆積的孔隙中,細顆粒本身的膨脹不僅對磚坯的膨脹影響小,而且因具有較大的比表面積,在高溫下與礦化劑作用而使燒結能力增加。因此,希望在磚坯中有足夠數量的細顆粒含量,以提高磚坯昀燒結性。礦化劑必須在球磨機中細磨,使大於0.5mm的顆粒不超過1%~2%,小於0.09mm的顆粒大於80%。
符合粒度要求的原料選好後,可進入成形階段製備矽磚坯料。坯料的成形性能受顆粒組成、水分和加入物的影響,調整這些因素可以改善坯料的成形性能。由於矽質坯料的結合性和可塑性都很差且質硬,因此,為了保證製得緻密磚坯,需要採用加壓成形,通常成形壓力應不低於100~150MPa。
將成形並乾燥後的磚坯送入燒成窯內燒結。在燒成過程中伴隨有大量的物理化學變化,如磚坯中殘餘水的排除,石灰乳的脫水反應,二氧化矽的晶型轉換,氧化鈣與二氧化矽、氧化鐵與二氧化矽的固相反應等。根據這些變化的特點,可制定出燒成制度。在600℃以下時,雖有β-α的二氧化矽晶型轉變以及伴隨的體積變化,但由於坯體的導熱性差,加熱時的坯體中心部位溫度低於表面溫度,因此β-α石英轉變不是在瞬間完成的,而是發生在某一溫度範圍,在坯體內不會引起很大的應力,且對坯體強度影響不大,因此,在此階段,可用較快而均勻的升溫速度燒成,通常在20~600℃間的升溫速率為20℃/h;在600~1100℃溫度範圍內,因磚坯體積變化木大,強度逐漸提高,不會產生過大熱應力,在保證磚坯均勻加熱的前提下,可快速升溫,一般採用250℃/h的升溫速度;在1100℃至燒成最高溫度範圍內,晶型轉變及體積變化均很顯著,它是決定磚坯出現裂紋與否的關鍵階段,這個階段升溫速度應逐漸降低,並能緩慢均勻升溫。矽磚最高燒成溫度應不超過1430℃。燒成溫度過高時,方石英生成量多,導致燒成廢品率增加。矽磚燒成至最高燒成溫度時,通常根據製品的形狀大小、窯的特性、晶型轉變難易、製品要求的密度等給以足夠的保溫時間,一般波動在20~48h。
矽磚燒成後,高溫下(600~800℃以上)可以快冷;低溫時因有方石英和磷石英的快速晶型轉變,產生體積收縮,故應緩慢冷卻。
矽磚的使用
矽磚的使用主要從它在600℃以上耐溫度急變性能的好壞來考慮。矽磚在急冷急熱時易產生開裂,因此應特別注意哪些部位經常在這個溫度範圍內變化,如煉焦爐、煤氣發生爐、空氣加熱器、電爐爐頂等。另一個使用區域是熔窯建築後的烤窯溫度範圍。新窯烤窯時需要從室溫升溫到玻璃熔化溫度。因此,耐火材料在烤窯過程中將發生一系列晶型轉變和體積效應。由於矽磚在200℃到700℃溫度範圍內有較大的熱膨脹,烤爐時必須十分仔細地制定升溫曲線並嚴格控制升溫速度。矽質耐火材料除矽磚外,還有特種矽磚、石英玻璃及其製品等。
矽質耐火材料顯微結構
由鱗石英、方石英、殘餘石英、矽酸鹽、玻璃相等構成多相非均一型的結構。鱗石英、方石英、矽酸鹽及玻璃相構成基質結構單元。斜方晶系低溫型γ鱗石英常以六方晶系高溫型α鱗石英轉變後的假象體形式存在,或以 (10T6)雙晶結合面構成 楔形雙晶體 (見圖)。γ鱗石英的體積分數和直接結合率是評估鱗石英化程度和網路結構連續性的定量參數。
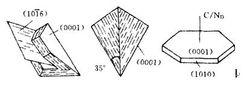 鱗石英的晶形及光性方位
鱗石英的晶形及光性方位假矽灰石、鈣鐵輝石、鈣鐵橄欖石及矽酸二鈣等組成矽酸鹽相,以分散或微區富集方式賦存於鱗石英網路的空隙部位。分布不均的鐵的氧化物尚能以α-FeO相的形式出現於基質之中。亞穩或穩態方石英,殘餘石英等構成顆粒結構單元。亞穩方石英系870~1470℃之間α方石英的介穩相,單偏光系統下呈均質性效應,在X射線衍射譜圖中難以與穩態方石英區別。α石英向亞穩方石英轉化的初期階段,亞穩方石英構成連續網路,將殘餘石英分隔成孤立島狀體。繼續熱過程,殘餘石英體積分數降低,或從顆粒結構單元中消失。顆粒邊緣的棕色反應層,由玻璃相、鱗石英、亞穩方石英組成,系基質中礦化劑與顆粒作用的產物。
矽質耐火材料的分析方法
矽質耐火材料(矽磚、矽水泥)的主要原料是石英 岩(包括石英砂)。其主要成分是二氧化矽,常含有微量 鐵、鋁、鈣、鎂等雜質。SiO和雜質的含量是劃分礦石等級的依據。
矽質耐火材料的主要分析方法如下:
重量法(鹽酸法)測定二氧化矽
稱取試樣0.5g,放在裝有無水碳酸鈉4g的鉑坩堝中,混勻,另取無水碳酸鈉1g,覆蓋其上,加蓋。置於高溫爐內,從低溫逐漸升高溫度至1000℃左右熔融,待完全熔解,旋轉坩堝,冷卻,將坩堝置於250mL瓷皿中,用熱水浸出,慢慢加入HCl(1+1)30mL,使其分解。將瓷皿置水浴上蒸發至近乾,壓碎,繼續乾燥至乾涸,稍冷,加濃HCl 15mL,再在水浴上蒸發至無HCl味為止,然後在烘箱內於130℃乾燥1h。稍冷,加濃HCl 20mL,靜置5~10min,加熱水70~80mL,攪拌,用慢速定量濾紙過濾,用熱HCl(5+95)洗滌沉澱3~5次,再用熱水洗至無Cl將濾液移於原瓷皿中,於水浴上再蒸至乾涸,按上述步驟過濾和洗滌將兩次沉澱連同濾紙置於鉑坩堝中,乾燥,灰化,移入高溫爐內,逐漸升溫,在1000~1100℃灼燒1h,冷卻,稱重並直至恆重。灼燒後的沉澱按氫氟酸法處理。按理論值計算SiO的含量。
氫氟酸法測定(適用於二氧化矽>93%的試樣)
將測定灼燒減量後的試樣,用水潤濕。加HSO(1+1)10滴、濃HF 10mL,加蓋,在低溫處加熱至試樣分解,用少量水沖洗坩堝內壁,再加HF 5mL,並繼續加熱蒸發至冒硫酸煙,近乾。加HSO(1+1)5滴、HF 2~3mL,繼續蒸發至SO白煙冒盡,置於高溫爐內,在900℃灼燒30min,冷卻,稱量,並灼燒至恆重。按理論值計算試樣中SiO含量若試樣中Ca、Mg、K、Na含量較高時,由於生成的硫酸鹽難以完全分解,導致結果偏低,這時應以硝酸代替硫酸必須使用鉑坩堝。
重量法測定Fe、Al、Ti氧化物總量
將氫氟酸法揮發盡SiO後留在鉑坩堝內的殘渣用焦硫酸鉀5g熔融至透明狀。冷卻,熱水浸出。加濃HCl 10mL,溶解,用水稀至150~200mL,加氯化銨飽和溶液15mL,加熱至沸,加1g·L甲基紅指示劑2~3滴,滴加氨水(1+1)至試液變黃色並過量1~2滴。煮沸,靜置,用快速定量濾紙過濾。用20g·L硝酸銨洗滌至無Cl(精確分析時將沉澱用HCl溶解,作第二次沉澱)。濾液保留,供測鈣鎂用將沉澱連同濾紙置於恆重的鉑坩堝或瓷坩堝中,低溫灰化,於1000~1100℃灼燒1h,取出,冷卻,稱量直至恆重。按理論值計算RO總量。
磺基水楊酸光度法測定氧化鐵
將測定RO總量後鉑坩堝或瓷坩堝內的殘渣用焦硫酸鉀4~6g熔融至透明狀,用熱水浸取,加濃HSO3~5mL,使溶解,移入100mL容量瓶中,用水稀釋至刻度吸取上述試液5~10mL於100mL容量瓶中,加300g·L磺基水楊酸10mL,滴加氨水(1+1)至呈穩定黃色後過量3~5滴,用水稀釋至刻度。用1cm液槽,於430nm波長處,用試劑空白作參比測定吸光度,從校正曲線上查得FeO的含量。
EDTA滴定法測定氧化鐵
將揮發SiO後鉑坩堝內的殘渣,按RO總量測定步驟操作,沉澱用熱HCl(1+1)溶解,洗滌濾紙,並稀釋至約100mL(供測Fe、Al用)。濾液承接於200mL容量瓶中,以水稀釋至刻度(供測Ca、Mg用)在上述供測鐵、鋁試液中,滴加氨水(1+1)至出現渾濁,用HCl(1+1)滴至沉澱恰溶解並過量5滴(此時試液pH=2),加100g·L磺基水楊酸10滴,加熱至50~60℃,用EDTA標準溶液(0.01mol·L)滴定至試液由紫紅色變為亮黃色或無色即為終點試液保留供測鋁用。按理論值計算FeO的含量。
EDTA滴定法測定氧化鋁
在滴定完鐵的試液中,準確加入EDTA標準溶液(0.01mol/L)10~20mL(視Al含量而定,一般過量5~10mL),加pH4.7 HOAc-NaOAc緩衝液15mL,用水稀釋至約150mL,加熱煮沸2min,取下,稍冷,加1g·LPAN指示劑10滴,用硫酸銅標準溶液(0.005mol·L)滴定至試液由黃色變為穩定的紫紅色或紫藍色即為終點。按理論值計算AlO的含量。
EDTA滴定法測定氧化鈣
吸取上述供測Ca、Mg的試液100mL於500mL錐形瓶中,用水稀釋至150mL,加三羥乙基胺(1+4)2~5mL、200g·LNaOH 20mL、鈣指示劑NN適量,用EDTA標準溶液(0.01mol/L)滴定至試液由紅色變為純藍色即為終點。按理論值計算CaO的含量如試樣不含鎂或含鎂極少,加入鈣指示劑試液的紅色不明顯時,可在試液中加入5g·LMgO溶液3~4滴,以下操作同上。
EDTA滴定法測定氧化鎂
吸取上述供測Ca、Mg的試液100mL於500mL錐形瓶中,用水稀釋至150mL,加三羥乙基胺(1+4)2~5mL、pH10氨性緩衝液20mL,加絡黑T指示劑適量,用EDTA標準溶液(0.01mol/L)滴定至試液由紅色變為純藍色即為終點。按理論值計算MgO的含量試樣不含鎂或含極微量鎂,加絡黑T指示劑後,試液的紅色不明顯時,則可在另移取的試液中加Mg-EDTA(1mL相當於0.5mg MgO)1mL,然後再按上述分析步驟進行測定如試樣中含錳時,則在分取的試液內先加鹽酸羥胺0.1g,再按分析步驟測定Ca、Mg、Mn含量。另外,單獨用光度法測定MnO。從計算後的MgO+MnO的合量減去MnO(%)×0.57,得校正後的MgO的含量。

