定義
在反應過程中,若發生反應的部位位於反應分子平面兩側的稱為異面反應,用a表示。一般同面和異面的概念常用來描述軌道反應。
背景知識
價鍵理論
未成對自旋相反電子偶合配對,成鍵原子的電子云相互交蓋重疊形成共價鍵,成鍵電子云定域於兩原子之間;共價鍵具有飽和性。如一個原子的未成對電子已配對成鍵,就不能再與其它原子的未成對原子配對成鍵;共價鍵具有方向性。電子云重疊愈多,形成的鍵愈強,因此要儘可能在電子云密度最大的地方重疊;能量相近的原子軌道可以進行雜化,組成能量相等的雜化軌道,這樣可使成鍵能力更強,體系能量降低,成鍵後達到最穩定的分子狀態。
分子軌道理論
分子軌道由原子軌道通過線性組合而成,形成的分子軌道數與參與組成的原子軌道數相等,分子軌道有成鍵分子軌道、非鍵分子軌道和反鍵分子軌道。原子軌道組成分子軌道時,必具備能量相近、電子云最大重疊及對稱性相同三個條件。成鍵電子云離域於整個分子。
分子軌道的能量隨節面數的增多而增多。
有效成鍵三原則
分子軌道理論認為化學鍵有效生成必須滿足三個基本原則:
1)能量近似原則
兩個能量相差很大的原子軌道組成分子軌道時,成鍵軌道的能量之和與原子軌道的能量近,即在成鍵過程中能量降低很少,故不能形成穩定的分子軌道.
2)電子云最大重疊原則
兩個原子軌道的電子云重疊程度越大形成的化學鍵越牢固。
3)對稱性相同原則
只有對稱性相同的原子軌道才能組成分子軌道。
異面反應的類型
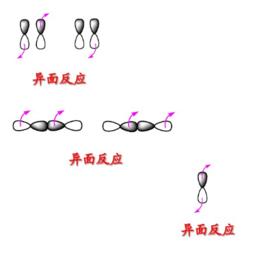
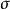 異面反應
異面反應(1)鍵的異面反應
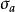 異面反應
異面反應反應在中間一瓣或者另一瓣間進行是異面反應,用表示。異面斷裂後,此時鍵連的兩個原子軌道一個原子以正瓣成鍵並保持構型,另一個原子以負瓣成鍵並翻轉構型。
 異面反應
異面反應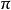 異面反應
異面反應(2)鍵的異面反應
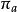 異面反應
異面反應反應在兩側發生的是異面反應。
 異面反應
異面反應(3)單一非鍵空p軌道的異面反應
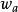 異面反應
異面反應反應在兩側發生的是異面反應。
 異面反應
異面反應重要的套用-周環反應判斷原則
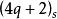 異面反應
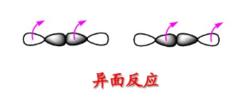
異面反應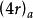 異面反應
異面反應判斷周環反應的或規則。
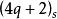 異面反應
異面反應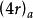 異面反應
異面反應現將判斷周環反應的選擇規則統一為一個規則:或規則(q、r為整數,包括0。s:表示同面反應,a:表示異面反應)。
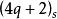 異面反應
異面反應即參加周環反應的電子總數為4q十2(或電子對數為奇數)時,同面反應為熱允許反應。
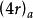 異面反應
異面反應即參加周環反應的電子總數為4r(或電子對數為偶數)時,異面反應為熱允許反應。
Dewar-Zimmerman規則:
 異面反應
異面反應Woodward-Hoffmann規則:
 異面反應
異面反應將Dewar-Zimmerman和Woodward-Hoffmann規則統一為一個規則是因為這兩個規則的實質是一致的,都是以分子軌道的基本概念為基礎,從不同的角度分析周環反應過程的能量變化關係,以期找出能量最低的過渡狀態,判斷反應進行的方式和立體化學選擇規則。
一個周環反應是熱允許反應還是熱禁阻反應從本質上講當然是軌道對稱守恆的問題,也可以認為主要決定於兩個因素:(l)參加反應的電子總數(或電子對數);(2)反應進行的方式,是同面反應還是異面反應。我們發現,每增加一對電子允許反應就成了禁阻反應,若換一種反應方式即同面反應換成異面反應,或異面反應換成同面反應,則反應仍為允許反應。
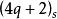 異面反應
異面反應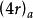 異面反應
異面反應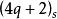 異面反應
異面反應Dewar一Zimmerman規則的實質是討論周環反應形成的環狀過渡態的芳香性(穩定性),若與相應的開鏈化合物相比是穩定的,則為允許反應,否則為禁阻反應。根據芳香過渡態理論,Hukel型過渡態中各原子軌道間的位相符號發生零次變化或偶數次變化,這裡實際上進行的是同面反應。而Mobuis型過渡態中各原子軌道間的位相符號發生奇數次變化,發生的是異面反應,所以說的就是Huckel型過渡態的情況。說的是Mobuis型過渡態的情況。 Woodward一Hoffmann規則從分析所有參與反應的分子軌道的對稱性人手,判斷周環反應進行的條件和方式,討論的是Huckel體系,表2所述選擇規則是建立在同面反應的基礎上的,也就是說Woodward一Hoffmann規則即可用概括。
在電環化反應中,順旋即為異面反應,對旋即為同面反應,在基態下4n體系順旋,4n十2體系對旋為允許反應,與上述規則一致。
在環加成和遷移反應中,兩組份的電子總數為(4q+2)時(或電子對總數為奇數時),同面一同面(s~s)反應或異面一異面(a~a)反應為熱允許反應,若兩組份電子總數為(4r)時(或電子對總數為偶數時),同面一異面(s~a)或異面一同面(a~s)反應為熱允許反應。
綜上所述,在周環反應中參與反應的電子總數為4n+2的同面反應或參與反應的電子總數為4n的異面反應為熱允許反應,反之為熱禁阻或光允許反應。