概述
高分子微球以其分子結構的可設計性吸引了越來越多的科學工作者的興趣,進而更加快了其開發套用的步伐。美國等西方已開發國家在這一研究領域起步較早,技術力量已相當強。日本在這一研究領域中投入大量人力和財力,獲得了眾多的成果與專利。近年來我國也有不少的科研人員開始從事該領域的研究,並取得了一定的成果,但總的來說與國外相比仍有差距。
高分子微球可以通過選擇聚合單體和聚合方式從分子水平上來設計合成和製備,並且可以比較方便地控制其尺寸的大小和均一性,使之具有所需要的特定性能與功能。這種微觀結構和性能的可設計性,使得高分子微球在對材料特性要求較高的生物醫學領域中顯示出巨大的發展潛力。本文擬對近幾年來報導的幾種核-殼複合型高分子微球製備方法以及高分子微球在生物技術和醫學診治方面的套用加以綜述。
製備方法
生物醫用高分子微球通常為核-殼複合結構,其中殼層具有生物活性或對特定環境有親合性,而核作為這類活性大分子
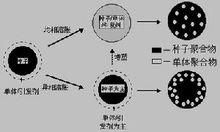 生物醫用高分子微球
生物醫用高分子微球的載體,使微球具有一定的穩定性;或者,核為具有一定生物功能性的高分子,而殼層作為保護層,維持核內物質的活性。
大分子單體法(Macromonomer Method)
大分子單體具有確定的分子量和明確的結構,所以近來被廣泛地用來製備高分子微球。首先將某一單體聚合成有一定聚合度的低聚物,再在低聚物上引入一具有聚合反應活性的基團(如碳碳雙鍵等),製得具有確定分子量的大分子單體。然後在含有大分子單體的介質中加入第二單體、引發劑,進行接枝共聚反應。若大分子單體為親水的,第二單體為疏水的,則水相中的大分子單體接枝到疏水性的第二單體上成雙親性接枝共聚物,並逐漸形成膠粒。疏水性單體可擴散到膠粒內,進一步參加共聚反應。親水性的大分子鏈則起到了穩定作用,防止膠粒的凝聚。於是形成了核為疏水,殼為親水的高分子微球。反之,也可用逆相乳液聚合的方法製備疏水性高分子微球。微球的大小及其分布可以通過溶劑組成和加入的單體及大分子單體的量來控制。其大小可從幾十nm到幾十mm的範圍內變化。由於其形態的可控性及溫和的聚合條件使得此類微球被廣泛地套用於生物醫學領域。
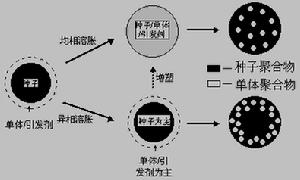
1種子聚合法(Seeded Polymerization)與動態溶脹法(Dynamic Swelling Method)
 生物醫用高分子微球
生物醫用高分子微球分步異相凝聚法(Stepwise Heterocoagulation Method)
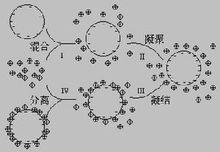
首先用乳液聚合法分別合成帶有正電荷的小粒徑高分子微球和帶有負電荷的大粒徑微球。利用靜電吸引,在溶液中將小微球吸附到大微球的表面,形成外表面較為粗糙的微球聚集體。加熱溶液至小微球的玻璃化溫度(Tg)之上。這樣,包附在大微球周圍的小微球將凝結成連續層,整個微球體系的表面隨著加熱時間的增加而變得光滑,最終可製得核-殼型高分子微球。等用分步異相凝聚法製備了一系列親水核-疏水殼的複合結構微球。該法製備的高分子微球大小一般從亞微米級到微米級不等。由於製備過程中往往加熱溫度較高,會導致活性物質的失活,所以此類微球一般只適合於作為生物活性物質的載體。
1 線-球轉變法(Coil-to-globule Transition Method)
交聯的聚(N-異丙基丙烯醯胺)(PNIPAAm)水凝膠微球的流體動力學尺寸(hydrodynamic size)隨溫度變化而變化,同時微球表面的親水/疏水性也隨之發生變化。利用PNIPAAm的這一熱敏特性,Qiu等合成了主鏈為PNIPAAm,支鏈為親水性聚合物(如聚環氧乙烷PEO)的線狀接枝共聚物。該線狀共聚物在加熱至PNIPAAm的低臨界溶解溫度(LCST)之上時,水溶液中的PNIPAAm鏈因脫水而聚集在一起,成為疏水核,而水溶性的PEO支鏈分布在核的周圍,成為親水殼層,於是形成了核-殼結構的高分子微球,親水的PEO層對微球起著穩定作用;當溫度重新降低至LCST之下後,微球回復到原來的線狀狀態。這一過程為可逆過程。線狀共聚物也可以是嵌段共聚物,通過改變溶劑或溫度來選擇性地降低某一嵌段部分的溶解性,從而通過線-球轉變製備核-殼結構微球。用線-球轉變法製備的微球常用作藥物靶向的載體。
對於具有一定生物醫學功能的單體, 可以用上述幾種方法直接製備出具有醫用功能的高分子微球,而對一些沒有這類功能的高分子微球,則可以通過對微球表面進行功能化處理而使微球表面帶有功能基團(如-COOH,-NH2, -CHO等)。另外,為了得到特定形態的微球,還可以適當改變合成步驟和條件,或者對製備好的微球進行一些特殊處理,如為了得到多孔高分子微球,可以採用逐步鹼/酸法或鹼/冷法。
具體套用
細胞功能測定
利用某些細胞(如巨噬細胞)對具有某種特定結構的異物的吞噬作用來測定細胞的功能。Wagner等發現顆粒狀白血球細胞對聚苯乙烯(PS)微球和表面用血清蛋白覆蓋的PS微球具有不同的吞噬能力,其中PS微球較容易被吞噬,從而可通過比較細胞對微球異物的吞噬能力來判斷該細胞功能正常與否。具體方法是在微球上導入發色團,通過測定其發光度的變化加以判斷。張文軍等用有封閉活性的抗鈣粘蛋白(N-cadherin)單抗包被的PS微球與表達鈣粘蛋白的人胚肺細胞接觸後,誘導細胞膜上的鈣粘蛋白聚集在微球周圍。通過分子免疫螢光定位分析,揭示細胞內粘著斑分子間相互作用的鏈條關係及相關的信號通路。這是一種將細胞內蛋白質定位與功能研究有機結合的新技術。
生物大分子的純化分離
利用高分子微球對生物大分子的吸附/解吸來達到純化分離的目的。PNIPAAm微球在其LCST上下流體動力學尺寸和親水/疏水性發生變化,這種熱敏特性已被用來純化分離一些生物大分子,如肌紅蛋白(MG)、a-乳清蛋白(LA)、溶菌酶(LZ)和核糖核酸酶A(RNase)等。將含熱敏性PNIPAAm的微球在溫度低於LCST條件下加入到待分離的生物大分子(如蛋白質)混合液中,此時微球因水合作用而膨脹,然後升溫至LCST以上,微球又因脫水而收縮,於是大量的生物大分子就吸附到微球上。將微球分離出來後,再在LCST 以下將吸附在微球上的生物大分子解吸下來。如此反覆操作,即可達到分離純化生物大分子的目的。
核酸雜交的固定
將固定在固相載體上的核酸作為探針進行核酸雜交在核酸技術中占有十分重要的地位。其原理是,固定化的單鏈核酸在溶液中與具有互補鹼基序列的多核苷酸片段冷卻時形成雙螺旋結構,從而達到對特定DNA的檢測和序列分析的目的。姚萍等將寡聚核苷酸的5'端定向聯接到或直接將單鏈的DNA的5′端聯接到表面帶有甲胺基(-CH2NH2)官能團的PS微球上,製得了長鏈的DNA探針。這種探針在較高溫度下仍有相當高的聯接效率。所以功能化的高分子微球是一種較為理想的核酸雜交的固定載體。
酶的固定化
把酶固定在微球上有物理吸附和化學結合兩種方式。通常化學結合有由共價鍵偶聯和由多功能基化合物交聯等,而直接的物理吸附力比較弱,通常還需用雙功能基化合物(如戊二醛,e-氨基己酸等)交聯。固定在功能性微球上的酶不僅具有較高的pH穩定性,熱穩定性和貯存穩定性,而且易與反應物分離,可以重複使用,提高使用效率。同時,多酶聯合固定化的微球可以促進多酶反應。柏正武等用聚丁二醯亞胺和3-氨基丙基矽膠製得微球,用作固定化酶的載體,其中聚丁二醯亞胺和3-氨基丙基矽膠之間以共價鍵相連,這種酶的固定化實用性強,便於工業化。
微球在醫學診治中的套用
免疫細胞檢查
利用表面帶有-COOH官能團的高分子微球在較溫和的條件下與免疫細胞物質中的-NH2發生偶聯的特性,把抗原固定到單分散微球的表面,然後加入抗體,利用抗體使固定抗原的微球發生凝聚的原理,再用分光光度計測定凝聚的有無和多少來測定免疫細胞量。
病毒脫除
其原理與生物大分子的純化分離類似。結合有一定生物活性分子的高分子微球對某些病毒具有很高的識別和親和能力。利用這種特性,就可以用它來分離除去一些較難用藥物治癒的病毒。Akashi等利用功能性高分子微球用於脫除HIV-1病毒(Human Immunodefi-ciency Virus-1,又稱愛滋病病毒),發現脫除率可達97%。脫除的方法是:首先在微球表面引入帶有羧基的高分子鏈,進而通過縮合反應把伴刀豆球蛋白A(Concanavalin A)固定到其表面。利用HIV-1病毒表面的活性基與伴刀豆球蛋白A發生凝聚反應,離心分離除去沉澱物,達到脫除病毒的目的。
藥物緩釋
解決藥物的持續穩定釋放這一難題,長期以來一直是用周期性服藥的方法來維持藥效。但仍不能避免藥物濃度的波動而帶來的毒副作用,而且藥物利用率低。用高分子微球結合或包裹藥物微粒可以使藥物從微球中逐步釋放出來,從而使受藥體系能保持較為穩定的藥物濃度,藥性得到持續發揮。目前的熱門課題是開發新型生物可降解微球,如聚乳酸、聚酯醯胺、聚e-己內酯、聚酸酐等或天然高聚物為材料的微球,通過控制微球的降解速率來實現藥物的長期恆量釋放,以更好地發揮療效。
靶向給藥
利用微球的結構特性和運載作用將藥物運送到特定的受藥部位,再將其慢慢釋放出來而達到治療效果。尤其對一些毒副性比較強的藥物,為了最大程度地發揮藥效和減少用藥劑量,儘可能避免大劑量藥物對其他正常組織的傷害,可利用靶向給藥來提高對病變部位的治療效果。骨質疏鬆症的治療主要是通過藥物降低體內血液中的鈣離子含量,增強自身造骨功能。常用的藥物是一種縮氨酸鮭魚降血鈣素(salmon calcitonin簡稱sCT),它是親水性的,若採用直接口服的方法,在胃中因酶的作用會很快分解而失去治療效果。通過用表面帶有親水PNIPAAm支鏈的PS微球作為載體,利用PNIPAAm的保護作用,把sCT直接運送到小腸中,使之被小腸直接吸收,達到與注射同樣好的治療效果 。用PNIPAAm為殼,PS為核的微球(膠粒)作為抗癌藥物亞德亞里黴素的載體來進行靶向給藥在實驗室試驗中已取得了較好的效果,具有廣闊的套用前景。