簡介
熱力學自由能(英語: Thermodynamic free energy)是指一個熱力學系統的能量中可以用來對外做功的部分,是熱力學態函式。自由能可以作為一個熱力學過程能否自發進行的判據。
對限定條件不同的熱力學過程,熱力學自由能有不同表達形式。最常見的有吉布斯自由能 G和亥姆霍茲自由能 A(或 F)。等溫等容過程用亥姆霍茲自由能 A = U - TS作為自發性判據;等溫等壓過程用吉布斯自由能 G = H - TS作為判據,式中 H為焓。兩者間存在 G = A + pV( p,壓強; V,體積)關係。
吉布斯自由能和亥姆霍茲自由能
亥姆霍茲自由能
主條目:亥姆霍茲自由能
系統經歷等溫、等體積的熱力學過程,可以用亥姆霍茲自由能作為自發性判據。亥姆霍茲自由能定義如下:
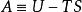 熱力學自由能
熱力學自由能對於一個系統的 等溫、等體積的熱力學過程:
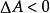 熱力學自由能
熱力學自由能: 過程能自發進行。
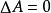 熱力學自由能
熱力學自由能: 系統處於熱力學平衡狀態。
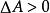 熱力學自由能
熱力學自由能: 過程無法自發進行。
其中, U是系統的內能, T是溫度, S是熵。
亥姆霍茲自由能的變化量等於一個系統在 等溫條件下能做的最大的功。即:
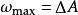 熱力學自由能
熱力學自由能吉布斯自由能
主條目:吉布斯自由能
對於等溫、等壓的熱力學過程,用吉布斯自由能作為該過程自發性的判據。由於化學實驗經常在等壓條件下完成,因此在化學領域中吉布斯自由能更常用。吉布斯自由能定義如下:
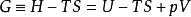 熱力學自由能
熱力學自由能其中, H是焓, T是溫度, S是熵, U是系統的內能, p是壓強, V是體積。
對於一個系統的 等溫、等壓以及無非體積功的熱力學過程:
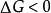 熱力學自由能
熱力學自由能: 過程能自發進行。
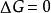 熱力學自由能
熱力學自由能: 系統處於熱力學平衡狀態。
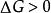 熱力學自由能
熱力學自由能: 過程無法自發進行。
對於體系有非體積功{\displaystyle \omega _{\text{add}}}的 等溫、等壓的熱力學過程,吉布斯自由能的變化等於系統能做的最大非體積功。即:
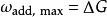 熱力學自由能
熱力學自由能上式在處理電功等非體積功問題中扮演了重要角色,例如燃料電池以及電化學電池的設計。
命名以及符號
“自由”一詞的來源
熱質說在熱力學發展初期,廣泛用來解釋與熱相關的物理現象。在熱質說中,“熱質”從高溫物體傳遞到低溫物體,並且發展了諸如自由熱(free heat),結合熱(combined heat)以及輻射熱(radiant heat)等概念。物體含有的全部“熱質”共分成兩部分,一部分是自由熱能,對溫度計有所改變者,稱為自由熱;另一部分無法對溫度計造成影響,叫做潛熱(latent caloric)。
19世紀中期,英國物理學家焦耳的熱功當量實驗揭示熱只是一種能量的形式。但是熱質說的影響一直延續到19世紀末。1882年德國物理學家亥姆霍茲延續熱質學說把 F = E - TS一項叫做“自由能”。用來表示在特定限定下可以“自由”做功的能量總量。等溫等壓條件下的吉布斯自由能 G = H - TS也延續了“自由”一詞。
1988年IUPAC會議對一些科學術語進行規範,討論建議去掉“自由”一詞,直接稱“吉布斯能”(“亥姆霍茲能”同理)。隨後,使用“吉布斯能”、“亥姆霍茲能”的書籍、文獻越來越多。但是,截止2016年,仍有大量書籍、文獻繼續使用“吉布斯自由能”以及“亥姆霍茲自由能”。
符號規定
IUPAC建議用字母 A(德語“Arbeit” ,功)作為亥姆霍茲能的符號。字母 F也繼續使用。
