常見乾燥劑
:
酸性乾燥劑
1、濃硫酸:
適用範圍:中性及酸性氣體。
不適用範圍:有機不飽和化合物(烯,炔等)鹼性物質。
2、五氧化二磷:
適用範圍:主要用於乾燥有機物,由於生成的磷酸會覆蓋表面,所以常與載體連用。
不適用範圍:醇 有機酸 HCl(鹽酸) HF(氫氟酸)等。
3、十氧化四磷:主要用於乾燥濃硫酸。
鹼性乾燥劑
1、鹼石灰:主要用於乾燥鹼性氣體,不能幹燥酸類和酯類。
2、金屬鈉:用於乾燥非極性有機物,不能幹燥含水量過多的物質,否則有危險。
3、鹼金屬的氫氧化物:不能幹燥酸性物質。
中性乾燥劑
矽膠:可以乾燥除HF外的幾乎所有物質,摻入氯化鈷可以製成變色矽膠,用途非常廣泛(如食品保乾)。
鹽類乾燥劑
無水硫酸銅,氯化鈣,硫酸鎂,硫酸鈉,硫酸鈣,碳酸鉀等等,套用廣泛,其中氯化鈣要避免氨氣等有配合性的物質,以免失效。
洗氣的舉例
要除去氮氣中含有的少量的二氧化碳,水蒸氣,氫氣,某同學設計了如下實驗步驟,正確的操作順序是( )
1、 通過濃硫酸的洗氣瓶
2、 通過盛氫氧化鈉溶液的洗氣瓶
3、 通過盛有灼熱氧化銅的試管
這裡面是除去三種氣體,很明顯,濃硫酸是除去水蒸氣的;氫氧化鈉是除去二氧化碳的(但是注意,氣體從氫氧化鈉溶液裡面出來會帶出水蒸氣,所以,這步必須放在濃硫酸的前面,);灼熱氧化銅,是用來除去氫氣的,這個跟2差不多,氫氣被還原以後,也會生成水,所以正確的操作順序應該是231 。
最後總結,除去氣體,有水,水通常放最後除去。
檢驗氣體,檢驗水,水通常放第一步除去。
認為是231
不用3做為第一個的理由是。CO+H=CO+HO (合成水煤氣的反應、要加熱)
引入CO後無法在後二個步驟中除去。
所以先通過2,除去CO。
再通過3,除去H,這裡會有水生成了。
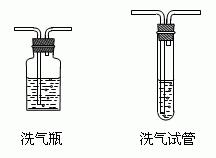 洗氣裝置
洗氣裝置最後通過1,完全將水除去。
洗氣方式
物理方式
氣體中需要被去除的雜質在洗液中溶解度較大,並且雜質氣體僅僅是單純的溶解於洗液。
化學方式
雜質氣體可以與水發生反應從而生成新的化合物溶解在洗液中或生成沉澱析出。例如:雜質氣體為氨氣用水做洗液,氨氣與水生成鹼性的氨水;雜質氣體為二氧化碳石灰水做洗液生成碳酸鈣沉澱。
注意事項
直型玻璃管(盛固),接短進短出。
裝置:廣口瓶或試管(盛液),長進短出。
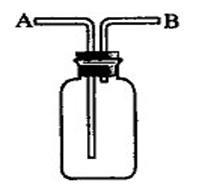 洗氣瓶
洗氣瓶溶液不會與所要提純的氣體發生化學或物理反應。
溶液在除去混合氣中非目的氣時不會產生新的雜質氣體。

