簡介
 波義耳定律
波義耳定律玻義耳定律(Boyle's law,有時又稱 Mariotte's Law或波馬定律,由玻意耳和馬里奧特在互不知情的情況下,間隔不久,先後發現):在定量定溫下,理想氣體的體積與氣體的壓強成反比。是由英國化學家波義耳(Boyle),在1662年根據實驗結果提出:“在密閉容器中的定量氣體,在恆溫下,氣體的壓強和體積成反比關係。”稱之為玻意耳定律。這是人類歷史上第一個被發現的“定律”。
公式
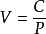 波義耳定律
波義耳定律V是指氣體的體積,P指壓強,C為一常數。
這個公式又可以繼續推導,理想氣體的體積與壓強的乘積成為一定的常數,即:PV=C (constant)。
如果在溫度相同的狀態下,A、B兩種狀態下的氣體關係式可表示成:PV=PV
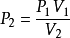 波義耳定律
波義耳定律習慣上,這個公式會寫成:
重大意義
波義耳創建的理論——波義耳定律,是第一個描述氣體運動的數量公式,為氣體的量化研究和化學分析奠定了基礎。該定律是學習化學的基礎,學生在學習化學之初都要學習它。
波義耳具有實驗天賦,還證實了氣體像固體一樣是由原子構成的。但是,在氣體中,原子距離較遠,互不連線,所以它們能夠被擠壓得更密集些。早在公元前440年, 德謨克里特就提出原子的存在,在隨後的兩千年里人們一直爭論這個問題。通過實驗,波義耳使科學界相信原子確實是存在的。
發現歷程
簡介
波義耳生於伯爵之家,是英國科學協會的會員。在1662年科學協會的會議上,羅伯特·胡克(Robert Hooke)宣讀了一篇論文,論文描述法國關於“空氣彈性”的實驗。17世紀,科學家對空氣特徵產生了濃厚興趣。
法國科學家製造了一個黃銅氣缸,中間裝有活塞,安裝得很緊。幾個人用力按下活塞,壓縮缸里的空氣。然後,他們鬆開活塞,活塞彈回來,但是沒有全部彈回來。不論他們隔多長時間做一次實驗,活塞總是不能全部彈回來。
通過這項實驗,法國科學家聲稱空氣根本不存在彈性,經過壓縮,空氣會保持輕微的壓縮狀態。
波義耳宣稱法國科學家的實驗不能說明任何問題。他指出,活塞之所以不能全部彈回來,是因為他們使用的活塞太緊。有人反駁道,如果活塞稍松,四周就會漏氣,影響實驗。
羅伯特·波義耳許諾要製造一個鬆緊適中的絕好活塞,證明上述實驗是錯誤的。
兩周后,羅伯特·波義耳手持“U”形大玻璃管站在眾會員面前。這個“U”形玻璃管是不勻稱的,一支又細又長,高出3英尺多,另一支又短又粗,短的這支頂端密封,長的那隻頂端開口。
波義耳把水銀倒進玻璃管中,水銀蓋住了“U”形玻璃管的底部,兩邊稍有上升。在封閉的短管中,水銀堵住一小股空氣。波義耳解釋,活塞就是任何壓縮空氣的裝置,水銀也可以看作“活塞”。向法國實驗所期望的那樣,波義耳的做法不會因為摩擦而影響實驗結果。
波義耳記錄下水銀重量,在水銀和空氣交界處刻了一條線。他向長玻璃管中滴水銀,一直把它滴滿。這時,水銀在短玻璃管中上升到一半的高度。在水銀的擠壓下,堵住空氣的體積變成不到原來的一半。
在短玻璃管上,波義耳刻下了第二條線,標示出裡面水銀的新高度和堵住空氣的壓縮體積。
然後,通過“U”形玻璃管底部的閥門,他把水銀排出,直到玻璃活塞和水銀的重量與實驗開始時的重量完全相等。水銀柱又回到它實驗開始的高度,堵住的空氣又回到它當初的位置。空氣果真有彈性,法國科學家的實驗是錯誤的,波義耳是正確的。
羅伯特·波義耳用玻璃活塞繼續實驗,發現了很多值得注意的事情。當他向堵住的空氣施加雙倍的壓力時,空氣的體積就會減半;施加3倍的壓力時,體積就會變成原來的1/3。當受到擠壓時,空氣體積的變化與壓強的變化總是成比例。他創建了一個簡單的數學等式來表示這一比例關係,現在我們稱之為“波義耳定律”。就認識大氣、利用大氣為人類服務而言,這一定律是極為重要的。
羅伯特·波義耳(Robert Boyle,1627年1月25日-1691年12月30日),愛爾蘭自然哲學家,在化學和物理學研究上都有傑出貢獻。雖然他的化學研究仍然帶有鍊金術色彩,他的《懷疑派的化學家》一書仍然被視作化學史上的里程碑。
求學
波義耳生於愛爾蘭沃特福德郡的萊斯城堡,是當時英國最富有的人“偉大的科克伯爵”理察·波義耳的第七個兒子。童年體弱但早慧,學會拉丁語和法語。八歲進入他父親朋友任教務長的伊頓公學。在伊頓期間他不喜歡參加體育鍛鍊並且常常生病。三年之後他在法國家庭教師陪伴下出國學習,在日內瓦度過了兩年。1641年前往義大利佛羅倫斯,研究伽利略的天文學著作與實驗。1643年理察·波義耳死於戰爭,為他留下了多西特莊園和遺產。1644年他回到愛爾蘭,看守莊園同時開始了他的科學研究。
科學研究與發現
1646年波義耳應邀加入了由威爾金斯組織的民眾性科學社團——“哲學學會”(又稱無形學院)這一社團成員常常在波義耳的莊園聚會交流。1648 年克倫威爾任命威爾金斯主持對牛津大學的改革,威爾金斯邀請波義耳到牛津去工作。1654年波義耳前往牛津,在自己的祖傳領地上建立了實驗室,聘請羅伯特·胡克為助手開始對氣體和燃燒進行研究。
1657年他在羅伯特·胡克的輔助下對奧托·格里克發明的氣泵進行改進。1659年製成了“波義耳機器”和“風力發動機”。接下來他用這一裝置對氣體性質進行了研究,並於1660年發表對這一設備的研究成果。這一論文遭到一些人反對,為了反駁異議,波義耳闡明了在溫度一定的條件下氣體的壓強與體積成反比的這一性質,法國物理學家得到了同樣的結果,但是一直到1667年才發表。於是在英語國家,這一定律被稱為波義耳定律,而在歐洲大陸則被稱為馬略特定律。
1661年波義耳發表了《懷疑派的化學家》,在這部著作中波義耳批判了一直存在的四元素說,認為在科學研究中不應該將組成物質的物質都稱為元素,而應該採取類似海爾蒙特的觀點,認為不能互相轉變和不能還原成更簡單的東西為元素,他說:“我說的元素...是指某種原始的、簡單的、一點也沒有摻雜的物體。元素不能用任何其他物體造成,也不能彼此相互造成。元素是直接合成所謂完全混合物的成份,也是完全混合物最終分解成的要素。”而元素的微粒的不同聚合體導致了性質的不同。由於波意耳在實驗與理論兩方面都對化學發展有重要貢獻,他的工作為近代化學奠定了初步基礎,故被認為是近代化學的奠基人。
1668年他離開牛津前往倫敦他姐姐的莊園居住。在倫敦他建立了自己的實驗室,主要進行化學方面的實驗。他努力把嚴謹的實驗方法引入化學。1673 年波義耳和胡克對物質的燃燒進行了研究,發現在真空情況下,物質無法燃燒。波義耳根據燃燒實驗的結果,寫成了論文《關於火焰與空氣關係的新實驗》,最先揭示了空氣是燃燒的必要條件。但是他仍然認為燃燒是火與物質之間的作用。另外波義耳還發現了某些植物的色素可以在酸性和鹼性條件下出現不同的顏色,從而引入指示劑的概念。1680年波義耳被選為英國皇家學會會長,但是由於誓言的問題,他拒絕了這一職務。
晚年生活
1689年之後波義耳本來就不是很好的健康繼續惡化,他退出了一切社會活動,結束了與皇家學會的關係,公開對不能接待來訪者進行道歉。在這種閒居中,他打算整理思想和文章,並希望從事一些秘密的傳給後人的化學研究。1691年12月30日,他姐姐去世後僅僅一周,波義耳去世。葬於聖馬丁教堂墓地,按照他的遺囑,他捐贈他寫的關於上帝存在討論的演講稿,以供後來學者進行討論。
社會評價
羅伯特·波義耳(Robert Boyle,1627年1月25日-1691年12月30日),愛爾蘭自然哲學家。雖然他的化學研究仍然帶有鍊金術色彩,他的《懷疑派的化學家》一書仍然被視作化學史上的里程碑。
化學
| 學科分支 | ||||||
|---|---|---|---|---|---|---|
| ▪無機化學 | ▪有機化學 | ▪物理化學 | ▪分析化學 | ▪理論化學 | ▪計算化學 | ▪生物化學 |
| ▪熱化學 | ▪電化學 | ▪光化學 | ▪藥物化學 | ▪量子化學 | ▪核化學 | ▪放射化學 |
| ▪天文化學 | ▪大氣化學 | ▪環境化學 | ▪綠色化學 | ▪信息化學 | ▪地球化學 | ▪石油化學 |
| ▪高分子化學 | ▪超分子化學 | | | | | |
| | | | | | | |
| 基本概念 | ||||||
|---|---|---|---|---|---|---|
| ▪分子 | ▪原子 | ▪元素 | ▪化學物質 | ▪化學命名法 | ▪離子 | ▪酸鹼性 |
| ▪氧化還原 | ▪化合物 | ▪摩爾 | ▪化學鍵 | ▪分子間力 | ▪化學反應 | |
| | | | | | | |
| 基本定律 | ||||
|---|---|---|---|---|
| ▪質量守恆定律 | ▪能量守恆定律 | ▪電荷守恆定律 | ▪阿伏伽德羅定律 | ▪朗伯比爾定律 |
| ▪波義耳定律 | ▪查理定律 | ▪菲克定律 | ▪蓋呂薩克定律 | ▪亨利定律 |
| ▪蓋斯定律 | ▪定組成定律 | ▪倍比定律 | ▪拉烏爾定律 | |
| | | | | |
物理定律
| 運動學 | |||
|---|---|---|---|
| ▪質心運動定律 | ▪歐拉運動定律 | | |
| | | | |
| 守恆律 | |||
|---|---|---|---|
| ▪能量守恆定律 | ▪動量守恆定律 | ▪角動量守恆定律 | |
| | | | |
| 力學 | |||
|---|---|---|---|
| ▪慣性原理 | ▪牛頓運動定律 | ▪萬有引力定律 | ▪克卜勒行星運動三定律 |
| ▪歐拉運動定律 | ▪胡克定律 | ▪帕斯卡定律 | ▪阿基米德定律 |
| ▪伯努利定律 | | | |
| | | | |
| 熱力學 | |||
|---|---|---|---|
| ▪阿伏伽德羅定律 | ▪理想氣體狀態方程 | ▪玻意耳定律 | ▪查理定律 |
| ▪蓋-呂薩克定律 | ▪道爾頓分壓定律 | ▪杜隆-珀蒂定律 | ▪格銳目定律 |
| ▪亨利定律 | ▪熱力學基本定律 | | |
| | | | |
| 電磁學 | |||
|---|---|---|---|
| ▪庫侖定律 | ▪電荷守恆定律 | ▪楞次定律 | ▪法拉第電磁感應定律 |
| ▪畢奧-薩伐爾定律 | ▪安培定律 | ▪高斯定律 | ▪洛倫茲力 |
| ▪麥克斯韋方程 | ▪歐姆定律 | ▪焦耳定律 | ▪基爾霍夫第一定律 |
| ▪基爾霍夫第二定律 | | | |
| | | | |
| 光學 | |||
|---|---|---|---|
| ▪光的折射定律 | ▪光的反射定律 | ▪斯涅爾定律 | |
| | | | |
| 量子力學 | |||
|---|---|---|---|
| ▪態疊加原理 | ▪薛丁格方程 | ▪狄拉克方程 | ▪莫塞萊定律 |
| | | | |
| 相對論 | |||
|---|---|---|---|
| ▪光速不變原理 | ▪相對性原理 | ▪洛倫茲變換 | ▪等效原理 |
| ▪愛因斯坦場方程 | | | |
| | | | |
化學定律
| ▪質量守恆定律 | ▪能量守恆定律 | ▪電荷守恆定律 | ▪阿伏伽德羅定律 |
| ▪朗伯比爾定律 | ▪波義耳定律 | ▪查理定律 | ▪菲克定律 |
| ▪蓋呂薩克定律 | ▪亨利定律 | ▪蓋斯定律 | ▪定比定律 |
| ▪倍比定律 | ▪拉烏爾定律 | | |
知識延伸——理想氣體
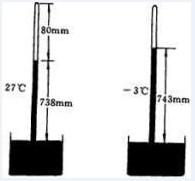 波義耳定律
波義耳定律中文名稱:理想氣體
英文名稱:ideal gas
定義1:一種具有以下特點的氣體:(1)服從馬略特和蓋-呂薩克定律,因而滿足理想氣體的狀態方程。(2)內能僅是溫度的函式。(3)比熱容與溫度無關。
套用學科:大氣科學(一級學科);動力氣象學(二級學科)
定義2:嚴格遵守理想氣體狀態方程 pVpnRT 的假想氣體。
套用學科:電力(一級學科);通論(二級學科)
嚴格遵從氣態方程(PV=(m/M)RT=nRT)的氣體,叫做理想氣體(Ideal gas.有些書上,指符合氣體三大定律的氣體。)從微觀角度來看是指:分子本身的體積和分子間的作用力都可以忽略不計的氣體,稱為是理想氣體。
定義
忽略氣體分子的自身體積,將分子看成是有質量的幾何點;假設分子間沒有相互吸引和排斥,分子之間及分子與器壁之間發生的碰撞是完全彈性的,不造成動能損失。這種氣體稱為理想氣體。
概述
氣態方程全名為理想氣體狀態方程,一般指克拉珀龍方程:pV=nRT。其中p為壓強,V為體積,n為物質的量,R為普適氣體常量,T為絕對溫度(T的單位為開爾文(字母為K),數值為攝氏溫度加273.15,如0℃即為273.15K)。
當p,V,n,T的單位分別採用Pa(帕斯卡),m3(立方米),mol,K時,R的數值為8.31。該方程嚴格意義上來說只適用於理想氣體,但近似可用於非極端情況(高溫低壓)的真實氣體(包括常溫常壓)。
性質
1.分子體積與氣體體積相比可以忽略不計;
2.分子之間沒有相互吸引力;
3.分子之間及分子與器壁之間發生的碰撞不造成動能損失;
4.在容器中,在未碰撞時考慮為作勻速運動,氣體分子碰撞時發生速度交換,無動能損失;
5.理想氣體的內能是分子動能之和。
