泡利原理
正文
 電子-模型圖
電子-模型圖 在給定n、l時,因m=0,±1,±2,…,±l,共有(2l+1)個狀態,在每一種狀態中的ms=+1/2或-1/2,因此在給定n、l時,共有2(2l+1)個m和 ms不全同的量子態, 即只能容納2(2l+1)個電子。l=0的狀態即s狀態,只能容納2個電子;l=1的狀態,即P狀態可容納6個電子;l=2時是d狀態,可容納10個電子;l=3的 f 狀態,可容納14個電子。總之,從泡利原理可以知道:原子中具有相同主量子數n的電子數目為2n:
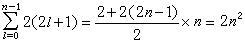
碳原子有6個電子,前4個電子的構型和鈹原子(見圖)
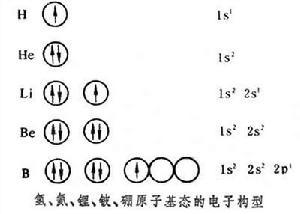 相同,最後兩個電子排在p軌道上,而2p有三個軌道,按照洪特規則(見電子構型)兩個電子排在兩個軌道上。
相同,最後兩個電子排在p軌道上,而2p有三個軌道,按照洪特規則(見電子構型)兩個電子排在兩個軌道上。