定義
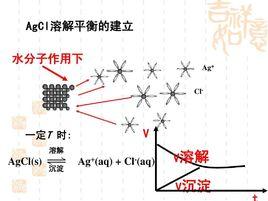
沉澱溶解平衡是指在一定溫度下難溶電解質晶體與溶解在溶液中的離子之間存在溶解和結晶的平衡,稱作多項離子平衡,也稱為沉澱溶解平衡。
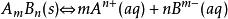 沉澱平衡
沉澱平衡AB固體在水中的沉澱溶解平衡可表示為: 。
難溶電解質在水中建立起來的沉澱溶解平衡和化學平衡、電離平衡等一樣,符合平衡的基本特徵,滿足平衡的變化基本規律。
沉澱平衡的特徵
沉澱平衡具有以下特徵,“逆”、“等”、“動”、“定”、“變”:
(1)“逆”:其過程為可逆過程;
(2)“等”:沉澱平衡過程的沉積和溶解速率相等;
(3)“動”:平衡為動態平衡;
(4)“定”:離子濃度一定;
(5)“變”:改變溫度、濃度等條件,沉澱溶解平衡會發生移動直到建立一個新的沉澱溶解平衡。
溶度積常數Ksp
溶度積常數的定義
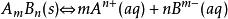 沉澱平衡
沉澱平衡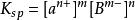 沉澱平衡
沉澱平衡難溶固體在溶液中達到沉澱溶解平衡狀態時,離子濃度保持不變(或一定)。各離子濃度冪的乘積是一個常數,這個常數稱之為溶度積常數簡稱為溶度積,用符號K表示。即: 。
溶度積常數的性質
(1)溶度積K的大小和平衡常數一樣,它與難溶電解質的性質和溫度有關,與濃度無關,離子濃度的改變可使溶解平衡發生移動,而不能改變溶度積K的大小。
(2)溶度積K反映了難溶電解質在水中的溶解能力的大小。相同類型的難溶電解質的Kp越小,溶解度越小,越難溶於水;反之K越大,溶解度越大。
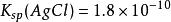 沉澱平衡
沉澱平衡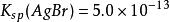 沉澱平衡
沉澱平衡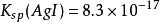 沉澱平衡
沉澱平衡如: , , ;
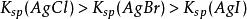 沉澱平衡
沉澱平衡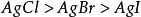 沉澱平衡
沉澱平衡因為 ,所以溶解度: 。
不同類型的難溶電解質,不能簡單地根據大小,判斷難溶電解質溶解度的大小。
沉澱平衡的影響因素
對於影響難溶物質溶解度的因素,重點應掌握同離子效應和酸效應。
同離子效應是指在沉澱反應中有餘難溶物質具有共同離子的電解質存在,使難溶物質的溶解度降低的現象。為了減少難溶物質的溶解損失,在沉澱時一般根據不同的情況需要加入不同過量數的沉澱劑,洗滌沉澱劑時也選擇合適的洗滌劑。
酸效應主要是指沉澱反應中,除強酸形成的沉澱外,溶液酸度對沉澱溶解度的影響。這種效應可用於難溶物質的溶解或防止難溶物質的生成;對於要獲得難溶物質的,就應注意控制溶液的酸度,以減少溶解損失。
沉澱平衡套用
判斷沉澱的溶解與生成
利用溶度積K可以判斷沉澱的生成、溶解情況以及沉澱溶解平衡移動方向。
(1)當Q>K時是過飽和溶液,反應向生成沉澱方向進行,直至達到沉澱溶解平衡狀態(飽和為止);
(2)當Q=K時是過飽和溶液時是飽和溶液,達到沉澱溶解平衡狀態;
(3)當Q<K時是不飽和溶液,反應向沉澱溶解的方向進行,直至達到沉澱溶解平衡狀態(飽和為止)。
以上規則稱為溶度積規則。沉澱的生成和溶解這兩個相反的過程它們相互轉化的條件是離子濃度的大小,控制離子濃度的大小,可以使反應向所需要的方向轉化。
判斷沉澱的轉化
所謂沉澱的轉化,是指在含有一種難溶物沉澱的溶液中,加入另一種沉澱劑,是原來的沉澱轉化成另一種沉澱。例如,在有AgCrO(磚紅色)沉澱的溶液中,滴加NaCl溶液,AgCrO4沉澱迅速地轉化成AgCl(白色)沉澱。
根據平衡移動原理,利用難溶物質的溶解度使沉澱進行轉化。即由一種難溶的物質(溶解濃度大)轉化成更難溶的物質(溶解濃度小)才能發生,反之,就難以使沉澱轉化,這就是沉澱轉化的條件。
因此,沉澱轉化的過程,實際上也是平衡移動原理的體現,其中包含兩個過程:舊沉澱的溶解和新沉澱的生成。舊沉澱的溶解度越大,新沉澱的溶解度越小,沉澱的轉化越容易進行,反之,就難於進行,甚至不可能。但是,在新沉澱和舊沉澱的溶解度相差不大的時候,兩個方向的轉化都有可能,這是轉化過程的方向取決於兩種沉澱例子濃度的大小。