相關歷史
 氮五正離子
氮五正離子美空軍從1986年開始的高能量密度物質研究項目,從1998年開始嘗試系統地研究氮原子簇化合物。當位於愛德華茲空軍基地的美國空軍研究實驗室開始對替代有毒的肼類火箭燃料感興趣時,同時為幾個這類計畫撥款。美國空軍研究實驗室的高級研究員Karl .O. Christed等 嘗試通過NF 和HN製備直線型的N 離子,理論和實驗表明,N–為一直線形共振結構,然而,仿照 N 的結構構建的直線形N5 在能量上是不利的。建立於CCSD(T)/6–311+G(2d)上的分子模擬計算結果指出:彎曲的 N+結構具有較好的穩定性。
NF AsF +HN→N AsF +HF
1999年時這個反應成功實現了,並製得了足量的N AsF ,因此才可以使用核磁共振、紅外光譜、拉曼光譜研究其特性。N AsF 是一種白色固體,微溶於無水 HF,在 22 ℃下勉強穩定,在 –78 ℃下可貯存數周而不發生明顯分解。它能夠在 HF 溶液中進行常規處理,在 –196 ℃下不鏽鋼藥匙壓碎時不發生爆炸,在 –130 ℃下可暴露在波長為 488 nm 的 Ar離子雷射束(1.5 W)中,也是一種強氧化劑,在低溫下可使有機物點火燃燒,遇水則猛烈爆炸。但是當AsF被更強的路易斯酸SbF替換時,可以製得更加穩定的鹽N SbF ,N SbF 是無色吸濕性固體,對震動不敏感,在60-70°C以下能穩定存在,但具有較強的氧化性。這使得這類化合物可以較大量地製備、更容易處理,也使得X射線晶體結構分析成為可能。
製備方法
合成過程包括多個步驟:
NF的合成:NHCONH→NFCONH→NHF→NF
NF還原為NF: 石墨+AsF→CAsFCAsF+NF→CAsF+trans-NF
NF的順 –反異構化:trans-NF+AsF→NFAsF NFAsF+NaF→NaAsF+cis-NF
合成N2FSbF:cis-NF+SbF→N2FSbF
合成NSbF:N2FSbF+HN→NSbF+HF
1.NF的合成:NHCONH→NFCONH→NHF→NF
2.NF還原為NF: 石墨+AsF→CAsFCAsF+NF→CAsF+trans-NF
3.NF的順 –反異構化:trans-NF+AsF→NFAsF NFAsF+NaF→NaAsF+cis-NF
4.合成N2FSbF:cis-NF+SbF→N2FSbF
5.合成NSbF:N2FSbF+HN→NSbF+HF
化學性質
N 能氧化水、NO、NO和Br,但不能氧化Cl和O。它的電子親和能為10.44 eV (1018.4 kJ/mol)。因此,N 必須在乾燥的環境中製備和處理。
由於氟銻酸鹽較穩定,它被用於製備所有其他已知的鹽,通常在非水溶劑比如HF、SO、CHF或CHCN中進行複分解反應來實現,因為這時氟銻酸鹽是難溶的:
2N SbF + A+B → N+5B + ASbF
含有N 的最穩定的鹽加熱到50 - 60°C時會分解:N SbF 、N5+SbF5?和NB(CF)。而最不穩定的鹽也已經製得並進行研究:N [P(N) ]和N [B(N) ]對震動極敏感,在室溫下就可能爆炸,即使稀釋到0.5 單位也會爆炸。有許多種N 的鹽不能形成,比如氟化物、疊氮化物、硝酸鹽和高氯酸鹽。
結構與成鍵
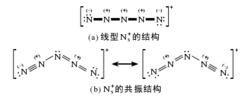
在價鍵理論中,五氮陽離子可以用六個共振結構表示:
[N≡N+-N--N+≡N]+ [N-=N+=N-N+≡N]+ [N≡N+-N=N+=N-]+
[N+=N-N--N=N+]+ [N+=N-N--N+≡N]+ [N≡N+-N--N=N+]+
根據量子化學從頭計算和X射線實驗的結果,這種離子中所有原子共面,空間構型為V形,中心氮原子的鍵角為111°(N2-N3-N4的夾角),而第二和第四個氮原子的鍵角為168°(N1-N2-N3和N3-N4-N5的夾角)。N1-N2和N4-N5的鍵長都是1.10A,而N2-N3和N3-N4的鍵長都是1.30A。