分類
氧化物催化劑通常可以分為兩六類:絕緣體和半導體。
絕緣體氧化物的陽離子只有單一價態,它們有固定的化學計量比M︰O,如MgO、AlO、SiO和某些矽鋁酸鹽分子篩等,這些氧化物多數用作酸、鹼催化劑。
半導體氧化物一般用於催化氧化反應,這些氧化物的金屬組成是易於變價的。如FeO、VO、TiO、CuO、NiO的金屬有兩種以上正氧化態,ZnO、CdO 則很易還原為零價金屬。
從根本上說,某些氧化物屬於蘭導體是由於它們有稍許過剩或缺少電子。電子過剩則帶負電荷,是n型半導體;而缺少電子則帶正電荷,是p型半導體。這兩類氧化物的吸附和催化性能顯著不同。
催化作用基本步驟
在催化氧化反應中廣泛採用金屬氧化物催化劑。進行催化氧化反應時,催化劑作用有如下幾個基本步驟組成:
1、使有機分子活化或有利於脫掉氫。
2、對氧的活化,使其有利於加成到被活化的反應物分子上去。
3、使兩種活化後的分子處於有利於相互作用位置(包括結構與電子性質的適應)以利於進一步反應。
在某些特殊情況下,催化劑僅僅活化反應物分子或氧分子,使其中之一分子活化到另一個分子能與其發生反應的程度。
氧化物催化劑性能調節
對於氧化物催化劑性能的調節作用可歸納成下述諸方面:
調節高價離子的穩定性
調節氧化物催化劑中高價離子的穩定性,就是調節其氧化還原特性。金屬氧化物的氧化狀態可利用多成分形成複合物和固溶體,利用複合化加以控制。
例如含銻的氧化物體系,這個體系中Sb 是烯烴的烯丙基型氧化的活性中心,銻的高價氧化態。但是單獨銻氧化物Sb 不易發生氧的解離,而且生成低價氧化物不易被氣相氧所氧化。在SnO—SbO體系中形成了固溶體,UO—SbO體系中形成了USbO和USb,又在FeO—SbO體系中形成FeSbO和表面化合物FeSbO,從而使Sb 穩定化,用複合方法找到了高活性催化劑。
利用複合方法使原子價穩定,不僅對在氧化性氣氛下使用的催化劑適用。在氧化脫氫等還原性氣氛中使用的催化劑也有效,如利用LaNiO、LaCoO等ABO鈣鈦礦型氧化物時,使NiO、CoO等單獨氧化物時難以生成的高價鈷和高價鎳穩定化屬於這類型,如LaCoO使乙烯氫解成甲烷反應中的壽命比CoO長。CuO-CuCrO複合物,而本質上是CuCrO(尖晶石)具有防止CUO還原作用。
調節催化劑的酸鹼性
催化氧化反應中,催化劑的酸鹼性也成為決定活性和選擇性的條件。這時,催化劑的酸鹼性往往與被氧化物質的活化及生成的中間體有關。
例如:丙烯的烯丙基型氧化中,氧化為丙烯醛與氧化脫氫成苯的反應發生競爭。丙烯首先是甲基位的氫在催化劑表面O 離子(鹼性點)作用下被氧化脫去成為烯丙基中間體配位在金屬離子(路易斯酸中心)上。這個烯丙基中間體是基團還是稍帶正電荷,決定於配位金屬離子的路易斯酸中心強度。催化劑弱鹼性時,烯丙基型中間體就成為基團,易發生二聚化。當催化劑為酸性,由於其親電子性使烯丙基中間體成為陽離子,易受O 離子的親核進攻成為丙烯醛。
 反應機理
反應機理在催化劑中引入結構與電子缺陷
利用金屬氧化物的複合化,在催化劑中引人結構與電子缺陷。利用此法就有不少能直接或間接提高催化劑活性與選擇性。金屬氧化物的表面結構缺陷很多起著吸附與反應活性點的作用。在適當體系,依靠複合化可以有意識引人缺陷。例如在具有CaWO結構的PbMO、CdMoO等中添加少量三價Bi離子,生成PbBiΦMoO、CdBiΦMoO等固溶體,引入陽離子缺陷Φ。由於此缺陷,使丙烯氨氧化活性顯著增加。
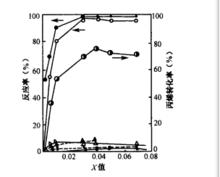 Pb1-3xBi2xΦxMoO4系中x值與丙烯氨氧化關係
Pb1-3xBi2xΦxMoO4系中x值與丙烯氨氧化關係改變催化劑的半導體性能
金屬氧化物的半導體性能可利用添加第二組分來改變,從而使反應物的吸附特性與反應性受到影響。例如,以添加ThO、LiO、NaO的ZnO催化劑,當催化劑的功函越大(費米能級越低),給出電子的性能變弱對氧的吸附產生不利。隨著功函式增加,氧化反應活性亦隨之降低,選擇性有增大傾向。對於近乎絕緣體的催化劑,電子移動有困難,活性降低,如在α—AlCrO上的異丙醇的分解活性和α—AlVO上NO分解活性都隨x值的不斷增大活性發生增大→減少→增大的過程。這是由於隨著導電性增大,活性點結構與性能發生變化造成。
