氣液相反應過程
正文
反應物系中存在氣相和液相的一種多相反應過程,通常是氣相反應物溶解於液相後,再與液相中另外的反應物進行反應;也可能是反應物均存在於氣相中,它們溶解於含有催化劑的溶液以後再進行反應。氣液相反應主要用於:①直接製取產品,例如使乙烯在PdCl2-Cu2Cl2的醋酸溶液中進行氧化以製取乙醛,用空氣氧化異丙苯以製取過氧化氫異丙苯等;②化學吸收,用以脫除氣相中某一種或幾種組分,例如用鹼液脫除半水煤氣中的二氧化碳和硫化氫等酸性氣體,用銅氨溶液脫除合成氣中的一氧化碳等。氣液相反應的理論基礎,主要是由日本學者八田四郎次於1928~1932年的工作奠定的。當氣相反應物 A與液相反應物B之間進行反應時,假設B不揮發,按雙膜理論(見相際傳質)可以認為反應經歷以下步驟:①分壓為pA的反應物A從氣相主體傳遞到氣液界面,在界面上A的氣相分壓為p岟,液相濃度為C岟,兩者處於相平衡狀態;②反應物A從氣液界面傳入液相,在液相內濃度為CA的A與濃度為CB的B進行反應;③反應所生成的液相產物沿濃度下降方向傳遞,氣相產物向界面傳遞;④氣相產物向氣相主體傳遞。為判斷傳質對反應的影響,八田提出:

-rA=βk忢C岟-rA
為反應區以相界面積計算的反應速率(見反應動力學);k忢為反應物A的液膜傳質係數;β為增強係數,表示化學反應使吸收速率增加的倍數。這類過程應採用相界面大的設備如填充塔、板式塔等,以加速反應進程。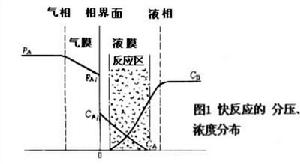 氣液相反應過程
氣液相反應過程-rL=kCACB
式中-rL為反應區以液相體積計的反應速率;k為反應速率常數,這類過程宜採用液相存貯量大的鼓泡反應器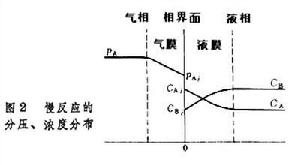 氣液相反應過程
氣液相反應過程當0.02<γ<2時,需同時考慮化學反應和傳質對反應速率的影響,計算較為複雜。
除雙膜理論外,溶質滲透理論和表面更新理論等相際傳質理論也已套用於氣液相反應的研究,但所得的結果與雙膜理論十分接近(見化學吸收、相際傳質)。

