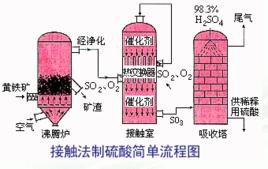
一.接觸法制硫酸
重點歸納
1.造氣所用的設備是沸騰爐,進入燃燒爐的應該是硫磺或者是經過粉碎的黃鐵礦和空氣,反應方程為
S(s)+O2 (g)==點燃==SO2(g) ΔH= -297kJ/mol
FeS2(s)+11/4 O2(g)==高溫==1/2 Fe2O3(s)+2SO2(g);ΔH=-853kJ/mol
4FeS2(s)+11O2(g)==高溫==2 Fe2O3(s)+8SO2(g);ΔH=-3412kJ/mol
從燃燒爐出來的氣體叫做爐氣.除去雜質和礦塵的目的是防止催化劑中毒,進行乾燥的原因是防止水蒸氣與二氧化硫形成酸對設備的腐蝕和在接觸室里對催化氧化的不良影響.
2淨化,乾燥的爐氣進入接觸室與催化劑接觸發生反應,反應方程為SO2(g)+1/2O2(g) ==催化劑== SO3(g); ΔH= -98.3kJ/mol(可逆反應!反應條件為400攝氏度到500攝氏度,五氧化二釩做催化劑.)
3吸收三氧化硫。在吸收塔中進行,塔中堆有瓷環.為了防止形成酸霧,一般用98.3%硫酸吸收三氧化硫,形成硫酸,然後再稀釋成所需濃度的硫酸.
二.環境保護與綜合利用原料
1.三廢是指廢氣,廢水,廢渣.
2硫酸工廠三廢的處理主要有:
(1)尾氣可用氨水吸收
(2)污水可用石灰乳處理
(3)廢渣可以作為制水泥的原料或用於制磚
三.能量的充分利用
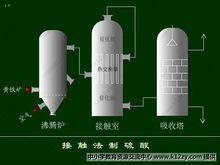 接觸法制硫酸
接觸法制硫酸在接觸法制硫酸中需要耗費大量的能量,其能量主要來自於生產中中產生的大量廢熱.此外能量的利用還有:在沸騰爐旁邊設定廢熱鍋爐,另外在接觸室里設定熱交換裝置,可以充分利用能源.