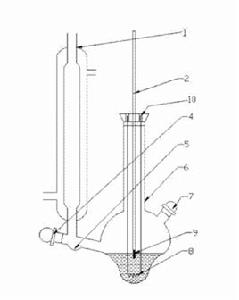
基本概念
在某些二組分氣液平衡溫度-組成(T~x)圖中,會出現一個最高或最低點,這一點能同時表示呈平衡的氣、液兩相所處的狀態,表示它們具有相同的溫度與組成。據相率分析,此時體系的自由度為0,即體系的各強度性質皆為常數。將具有該點對應組成的溶液進行蒸餾,可以看到其沸點始終恆定,故稱其為恆沸點。具有此點對應組成的溶液稱為恆沸溶液或恆沸混合物。顯然,這類恆沸溶液不能用蒸餾的方法加以分離。恆沸點分為最高恆沸點和最低恆沸點,如HCI與HO可構成具有最高恆沸點的體系,在101.325kPa下該點溫度為381.5K,HCI的質量分數為20.24%;乙醇-水體系擁有最低恆沸點(101.325kPa,351.29K,95.57%乙醇)。HCI-HO的恆沸溶液可作中和滴定的標準溶液使用。
最低恆沸點
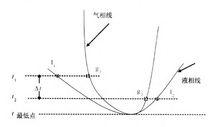 最低恆沸點的求法示意圖
最低恆沸點的求法示意圖具有最低恆沸點的相圖上,以恆沸點為分界,在同一溫度時,在恆沸點的左側,氣相組成大於液相組成;在恆沸點的右側,氣相組成小於液相組成。則實驗時,對測量數據表進行分析,找出由氣相組成大於液相組成轉變為氣相組成小於液相組成的相鄰的兩組數據,並將其按比例畫出來,通過兩個氣相組成畫出氣相線,通過兩個液相組成畫出液相線,並與畫出的氣相線相切,則可以找出最低恆沸點。