簡介
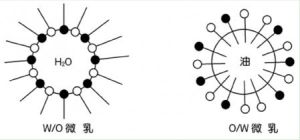
通常由油、水、表面活性劑、助表面活性劑和電解質等組成的透明或半透明的液狀穩定體系。分散相的質點小於0.1μm,甚至小到數十埃。其特點是分散相質點大小在0.01~0.1μm間,質點大小均勻,顯微鏡不可見;質點呈球狀;微乳液呈半透明至透明,熱力學穩定,如果體系透明,流動性良好,且用離心機100g的離心加速度分離五分鐘不分層即可認為是微乳液;與油、水在一定範圍內可混溶。分散相為油、分散介質為水的體系稱為O/W型微乳狀液,反之則稱為W/O型微乳狀液。微乳液一般需加較大量的表面活性劑,並需加入輔助表面活性劑(如極性有機物,一般為醇類)方能形成。廣泛套用於工業生產中,如地板拋光蠟液,機械切削油等。微乳液在石油開採中用於提高採收率。來歷
 微乳液
微乳液超低界面張力(10 - 6~10 - 7N/ m) 和很高的增溶能力(其增溶量可達60 %~70 %) 的穩定熱力學體系。
兩種互不相溶的溶劑在表面活性劑的作用下形成乳液,在微泡中經成核、聚結、團聚、熱處理後得納米粒子。其特點粒子的單分散和界面性好,Ⅱ~Ⅵ族半導體納米粒子多用此法製備。
微乳液是熱力學穩定、透明的水滴在油中(w/o)或油滴在水中(O/W)形成的單分散體系,其微結構的粒徑為5~70 nnl J,分為O/W 型和w/o(反相膠束)型兩種,是表面活性劑分子在油/水界面形成的有序組合體。1943年Schulman等在乳狀液中滴加醇,首次製得了透明或半透明、均勻並長期穩定的微乳液。1982年Boutnonet等 首先在W/O型微乳液的水核中製備出Pt,Pd,Rh等金屬團簇微粒,開拓了一種新的納米材料的製備方法。
微乳液通常由表面活性劑、助表面活性劑、溶劑和水(或水溶液)組成。在此體系中,兩種互不相溶的連續介質被表面活性劑雙親分子分割成微小空間形成微型反應器,其大小可控制在納米級範圍,反應物在體系中反應生成固相粒子。由於微乳液能對納米材料的粒徑和穩定性進行精確控制,限制了納米粒子的成核、生長、聚結、團聚等過程,從而形成的納米粒子包裹有一層表面活性劑,並有一定的凝聚態結構。
形成機理
常用的表面活性劑有:雙鏈離子型表面活性劑,如琥珀酸二辛酯磺酸鈉(AOT);陰離子表面活性劑,如十二烷基磺酸鈉(SDS)、十二烷基苯磺酸鈉(DBS);陽離子表面活性劑,如十六烷基三甲基溴化銨(CTAB);非離子表面活性劑,如TritonX 系列(聚氧乙烯醚類)等。常用的溶劑為非極性溶劑,如烷烴或環烷烴等。
將油、表面活性劑、水(電解質水溶液)或助表面活性劑混合均勻,然後向體系中加入助表面活性劑或水(電解質水溶液),在一定配比範圍內可形成澄清透明的微乳液。目前微乳液的形成機理主要包括以下幾種。
混合膜理論
Schulman和Prince認為微乳液是多相體系,它的形成是界面增加的過程他們從表面活性劑和助表面活性劑在油水界面上吸附形成作為第三相的混合膜出發,認為混合吸附膜的存在使油水界面張力可降至超低值,甚至瞬間達負值由於負的界面張力不能存在,從而體系自發擴大界面形成微乳,界面張力升至平衡的零或極小的正值因此微乳形成的條件是=γO/W-π<0(γ為微乳體系平衡界面張力;γO/W為純水和純油的界面張力;π為混合吸附膜的表面壓)。
但是油水界面張力一般約在50mN/m,吸附膜的表面壓達到這一數值幾乎不可能,因此應將上式中γO/W視為有助表面活性劑存在時的油水界面張力(γO/W)a,上式可變為:=(γO/W)a-π<0。助表面活性劑的作用是降低油水界面張力和增大混合吸附膜的表面壓。此外,助表面活性劑參與形成混合膜,能提高界面柔性,使其易於彎曲形成微乳液混合膜作為第三相介於油和水相之間,膜的兩側面分別與油、水接觸形成兩個界面,各有其界面張力和表面壓,總的界面張力或表面壓為二者之和。當混合膜兩側表面壓不相等時,膜將受到剪下力而彎曲,向膜壓高的一側形成W/O或O/W型的微乳液。
雙重膜理論
1955年Schulman和Bowcott提出吸附單層是第三相或中間相的概念,並由此發展到雙重膜理論作為第三相。混合膜具有兩個面,分別與水和油相接觸,正是這兩個面分別與水、油的相互作用的相對強度決定了界面的彎曲及其方向,因而決定了微乳體系的類型。表面活性劑和助劑的極性基頭和非極性基頭的性質,對微乳類型的形成至關重要。
R比理論
R比理論與雙重膜理論及幾何填充理論不同,R比理論直接從最基本的分子間的相互作用考慮問題。既然任何物質間都存在相互作用,因此作為雙親物質,表面活性劑必然同時與水和油有相互作用。這些相互作用的疊加決定了界面膜的性質。
定義R=(Ac0-AO0-AⅡ)/(AcW-AwW-Ahh)
Ac0:油與表面活性劑之間的內聚能
AcW:水與表面活性劑之間的內聚能
AⅡ:表面活性劑親油基之間的內聚能
Ahh:表面活性劑親水基之間的內聚能
當R<1時,形成水包油型微乳液,微乳液類型為WinsorⅠ型;
R>1時,形成油包水型微乳液,微乳液類型為WinsorⅡ型;
R≈1時,形成雙連續型微乳液,微乳液類型為WinsorⅢ型。
該理論的核心是定義了一個內聚作用能比值,並將其變化與微乳液的結構和性質相關聯。由於R比中的各項屬性都取決於體系中各組分的化學性質、相對濃度以及溫度等,因此R比將隨體系的組成、濃度、溫度等變化。微乳液體系結構的變化可以體現在R比的變化上,因此R比理論能成功地解釋微乳液的結構和相行為,從而成為微乳液研究中的一個非常有用的工具。
幾何排列理論
Schulman等人早期提出的雙重膜理論,從膜兩側存在兩個界面張力來解釋膜的優先彎曲。後來Robbins、Mitchell和Ninham等又從雙親物聚集體中分子的幾何排列考慮,提出界面膜中排列的幾何模型。在雙重膜理論的基礎上,幾何排列模型或幾何填充模型認為界面膜在性質上是一個雙重膜,即極性的親水基頭和非極性的烷基鏈,分別與水和油構成分開的均勻界面。在水側界面極性頭水化形成水化層,在油側界面油分子是穿透到烷基鏈中的。幾何填充模型成功地解釋了助表面活性劑、電解質、油的性質以及溫度對界面曲率,進而對微乳液的類型或結構的影響。
幾何排列模型考慮的核心問題是表面活性劑在界面上的幾何填充,用填充參數V/aolc來說明問題,其中V為表面活性劑碳氫鏈部分的體積;ao為其極性基的截面積;lc為其碳氫鏈的長度。對於有助表面活性劑參與的體系,上述各值為表面活性劑和助表面活性劑相應量的平均值。可見,填充係數反映了表面活性劑親水基與疏水基截面積的相對大小。當V/aolc>1時,碳氫鏈截面積大於極性基的截面積,有利於界面凸向油相,即有利於W/O型微乳液形成;當V/aolc<1時,則有利於O/W型微乳液形成;當V/aolc1時,有利於雙連續相結構的形成。
增溶理論
Shinoda和Friberg認為微乳液是脹大的膠團。當表面活性劑水溶液濃度大於臨界膠束濃度值後,就會形成膠束,此時加入一定量的油(亦可以和助表面活性劑一起加入),油就會被增溶,隨著進入膠束中油量的增加,膠束溶脹微乳液,故稱微乳液為膠團乳狀液。由於增溶是自發進行的,所以微乳化也是自動發生的。製備
原理
W/O型微乳液是由油連續相、水核及表面活性劑與助表面活性劑組成的界面三相構成,水核被表面活性劑與助表面活性劑組成的單分子層界面所包圍,形成單一均勻的納米級空間,所因此可以將其看作一個微型反應器。微乳液是熱力學穩定體系,在一定條件下具有保持穩定尺寸自組裝和自複製的能力,因此微乳液提供了製備均勻尺寸納米微粒的理想微環境。用W/O微乳液製備納米級微粒最直接的方法是將含有反應物A、B的兩個組分完全相同的微乳液溶液相混合,兩種微乳液的液滴通過碰撞融合,在含不同反應物的微乳液滴之間進行物質交換,產生晶核,然後逐漸長大,形成納米粒子。
用W/O體系製備微粒時,微粒的形成一般有以下三種情況:(a)將兩個分別增溶有反應物的微乳液混合,此時由於膠團顆粒間的碰撞、融合、分離和重組等,使兩種反應物在膠束中互相交換、傳遞,引起核內化學反應;(b)一種反應物增溶在水核內,另一種反應物以水溶液形式與前者混合,後者在微乳液體相中擴散,透過表面活性劑膜層向微乳液滴內滲透,在微乳液滴內與前者反應,產生晶核並生長;(c)一種反應物增溶在水核內,另一種為氣體,將氣體通入液相中充分混合,使二者發生反應而製得納米微粒。
方法
Schulman法:把油、水(電解質水溶液)及表面活性劑混合均勻,然後向體系中加入助表面活性劑,在一定配比範圍內體系澄清透明,即形成微乳液。
Shah法:把油、表面活性劑及助表面活性劑混合均勻,然後向體系中加入水(電解質水溶液),在一定配比範圍內體系澄清透明,形成微乳液。
影響因素
反應物濃度
適當調節反應物的濃度,可以控制納米顆粒的尺寸。當反應物之一過剩時,反應物的碰撞幾率增加,結晶過程比反應物恰好完全反應時的反應要快得多,生成納米顆粒的粒徑也就小得多。當反應物濃度越大,粒子碰撞幾率增加;當濃度大於膠束內發生成核的臨界值時,每個膠束內反應物離子的個數較多,反應物濃度的增加使產物的顆粒粒徑更小,單分散性越強。同時,反應物濃度的大小也直接影響著反應能力和成本高低。但當濃度過高時,體系的粘度增加,粒子易於聚集。表面活性劑
微乳液組成的變化將導致水核的增大或減小,水核的大小直接決定超細顆粒的尺寸,而水核半徑是由x=n(H2O)/n(表面活性劑)決定的。通常納米粒子的粒徑要比水核直徑大一些,這可能是由於水核間快速的物質交換導致水核內沉澱物的聚集所致。
在微乳液配製過程中,由於所選的油相、表面活性劑、助表面活性劑的種類不同,加入水相(電解質水溶液)後形成微乳液的組成比例就不同,增溶水量有差別。當油相、表面活性劑、助表面活性劑的種類相同情況下,在穩定溫度範圍內,水相加入量在一定範圍變化時,體系也可以形成微乳液。也就是說,增溶水量存在一個變化的最大極限,在極限範圍內,都可以形成微乳液。當超過這個極限時,微乳液便會分層。這個最大極限值通常被稱為最大增溶水量。
從微觀的角度分析,兩種微乳液的液滴通過碰撞、融合、分離、重組等過程,微水反應池問發生物質交換。由於水溶量的增大,造成單位體積內微水池數增多,大大增加了微水池之間的物質交換與碰撞的幾率,使微水池增大,迅速成核、長大,最後得到了粒徑較大的納米微粒。一般來說,隨著w的增加,所的產物的粒徑也呈現出遞增的趨勢。
界面膜強度
界面強度的大小也直接影響著納米顆粒尺寸的。因為當界面膜強度過低時,膠束在相互碰撞過程中界面膜易破碎,導致不同水核內的固體核或納米微粒之間發生物質交換,使得顆粒粒徑的大小難以控制;當界面膜強度過高時,膠束之間難以發生物質交換,使反應無法進行;只有當界面膜強度適當時,才能對生成的納米顆粒起到保護作用,得到理想的納米顆粒。影響界面膜強度的因素主要有:水與表面活性劑物質的量比、界面醇(即助表面活性劑,它能夠提高界面柔性,使其易於彎曲形成微乳液)濃度、醇的碳氫鏈長、油的碳氫鏈長等。
表面活性劑類型
表面活性劑在納米材料的製備過程中起著至關重要的作用,不同類型的表面活性劑對納米材料的形貌、尺寸等有一定的影響。它不僅影響著膠束的半徑和膠束界面強度,而且很大程度地決定晶核之間的結合點,從而有可能影響納米粒子的晶型。
陳化溫度
在熱力學穩定的溫度範圍內,微乳液呈各向同性、低黏度、外觀透明或半透明狀;而在熱力學穩定的溫度範圍以外呈各相異性。反應溫度對微乳液體系“微水池”的大小有很大影響。溫度過低,反應所需能量不能滿足,反應緩慢;溫度過高,不但使油相混合液揮發過快,反應環境縮小,並且微乳液熱力學穩定體系遭到破壞;而且使粒子相互碰撞加劇,產生團聚,粒徑過大。

