引物合成簡介
 引物合成
引物合成目前引物合成基本採用固相亞磷醯胺三酯法。亞磷醯胺三酯法合成DNA片段,具有高效、快速的偶聯以及起始反應物比較穩定的特點。亞磷醯胺三酯法是將DNA固定在固相載體上完成DNA鏈的合成的,合成的方向是由待合成引物的3′端向5′端合成的,相鄰的核苷酸通過3′→5′磷酸二酯鍵連線。引物合成特點
1.引物合成的純度高。
2.合成的序列長。
3.合成的效果好。
合成過程
第一步是將預先連線在固相載體上的活性基團被保護的核苷酸與三氯乙酸反應,脫去其5′-羥基的保護基團DMT,獲得游離的5′-羥基。
第二步,合成DNA的原料,亞磷醯胺保護核苷酸單體,與活化劑四氮唑混合,得到核苷亞磷酸活化中間體,它的3′端被活化,5′-羥基仍然被DMT保護,與溶液中游離的5′-羥基發生縮合反應。
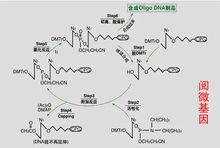 引物合成圖
引物合成圖第三步,帶帽(capping)反應,縮合反應中可能有極少數5′-羥基沒有參加反應(少於2%),用乙酸酐和1-甲基咪唑終止其後繼續發生反應,這種短片段可以在後續環節根據實驗需要來選擇純化方式分離掉。
第四步,在氧化劑碘的作用下,亞磷醯形式轉變為更穩定的磷酸三酯。
經過以上四個步驟,一個脫氧核苷酸被連線到固相載體的核苷酸上。再以三氯乙酸脫去它的5′-羥基上的保護基團DMT,重複以上步驟,直到所有要求合成的鹼基被接上去。合成過程中可以觀察TCA處理階段的顏色判定合成效率。通過氨水高溫處理,連線在CPG上的引物被切下來,通過OPC, PAGE等手段純化引物,成品引物用C18濃縮,脫鹽,沉澱。沉澱後的引物用水懸浮,測定OD260定量,根據定單要求分裝。
引物純化方式
1.C18柱脫鹽:有人稱其為簡易反相柱,它對DNA有特異性的吸附,可以被有機溶劑溶解洗脫,但不會被水洗脫,所以能有效地去除鹽分。它不能有效去除比目的片段短的小片段。這種方法一般不會對普通PCR反應產生影響。對於需要用於測序、克隆的引物不能使用這個級別。
2.OPC純化: OPC純化是根據DNA保護基(DMTr基)和Cartridge柱中樹脂間的親合力作用的原理進行純化目的DNA片段。
3.PAGE純:PAGE純化法是使用變性聚丙烯醯胺凝膠電泳,對DNA片段進行分離,然後從凝膠中回收目的DNA的方法。PAGE純化法也是一種非常有效的DNA純化方法,純化後的DNA純度大於95%,對長鏈Oligo DNA (大於50mer)的純化特別有效。
4.HPLC純化:HPLC純化是使用高效液相色譜的原理,對DNA片段進行純化。純度可以大於99%。主要用於短鏈和修飾引物的純化。
引物的OD數的定量
用紫外分光光度計,波長260nm,石英比色杯,光程為1厘米,測定溶液的光密度。測定時溶液的光密度最好稀釋到0.2-1.0之間。DNA乾粉用一定體積的水充分振盪溶解以後,用1ml水稀釋測OD值。需要根據稀釋倍數換算出母液的OD值。

