分類
受體細胞也叫宿主細胞。受體細胞有原核受體細胞(最主要是大腸桿菌)、真核受體細胞(最主要是酵母菌)、動物細胞和昆蟲細胞(其實也是真核受體細胞)。原核受體細胞中,最常用的宿主細胞是大腸桿菌。
過程
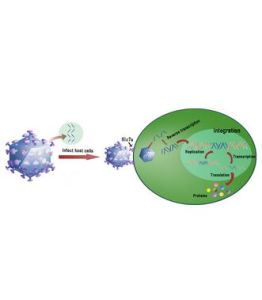
 宿主細胞病毒通常由具有蛋白質外殼的遺傳物質組成,它通過穿透細胞膜並向細胞釋放大量的病毒遺傳物質而感染細胞。利用宿主細胞上特定的膜上病毒輸送蛋白,進入感染的宿主細胞,向細胞釋放大量的病毒遺傳物質而感染細胞。由於細胞為無性體,因此它們依賴複製蛋白質或宿主細胞的“機體”來複製自己的DNA物質。從而篡奪細胞功能為其服務。其結果或使細胞死亡。病毒控制細胞。或著產生變異。正常細胞的蛋白質合成,細胞分裂是受結構基因、基因的調節系統所控制的。由於控制細胞增殖的結構基因發生突變,調節系統對它失去控制,結果就會造成細胞無限的增殖。如果是有關的調節基因發生了突變,它不再能產生有效的阻遏物質,控制增殖的結構基因的轉錄和翻譯就會不斷地進行,結果也將導致細胞的無限增殖。細胞發生變異。從而導致細胞癌變。
宿主細胞病毒通常由具有蛋白質外殼的遺傳物質組成,它通過穿透細胞膜並向細胞釋放大量的病毒遺傳物質而感染細胞。利用宿主細胞上特定的膜上病毒輸送蛋白,進入感染的宿主細胞,向細胞釋放大量的病毒遺傳物質而感染細胞。由於細胞為無性體,因此它們依賴複製蛋白質或宿主細胞的“機體”來複製自己的DNA物質。從而篡奪細胞功能為其服務。其結果或使細胞死亡。病毒控制細胞。或著產生變異。正常細胞的蛋白質合成,細胞分裂是受結構基因、基因的調節系統所控制的。由於控制細胞增殖的結構基因發生突變,調節系統對它失去控制,結果就會造成細胞無限的增殖。如果是有關的調節基因發生了突變,它不再能產生有效的阻遏物質,控制增殖的結構基因的轉錄和翻譯就會不斷地進行,結果也將導致細胞的無限增殖。細胞發生變異。從而導致細胞癌變。
相關報導
 宿主細胞美國賓夕法尼亞大學醫學院研究人員表示,他們發現Kaposi肉瘤相關皰疹病毒(KSHV)能夠欺騙受其感染的細胞完成病毒遺傳物質複製。KSHV的這種複製手段能使其不被人體免疫系統察覺。過去,人們認為KSHV需要病毒蛋白質啟動複製,新的研究結果顯示病毒能夠獨立地從宿主細胞中獲取蛋白質實現自我複製。病毒通常由具有蛋白質外殼的遺傳物質組成,它通過穿透細胞膜並向細胞釋放大量的病毒遺傳物質而感染細胞。由於細胞為無性體,因此它們依賴複製蛋白質或宿主細胞的“機體”來複製自己的DNA物質。此前研究人員通過對受KSHV感染的人體細胞研究,確定了表示病毒遺傳物質開始複製的一個基因,它是病毒蛋白質———潛伏相關核抗原(LANA)的編碼基因,LANA同病毒DNA相束縛。為了解KSHV的複製是否完全依賴於LANA,研究人員採用了沒有LANA的宿主細胞。結果發現,KSHV的DNA能夠套用細胞複製機制自動複製。研究報告首席作者、微生物學教授爾樂?羅伯遜博士指出,病毒再一次打破了人們對細胞的認識模式,並向人們展現了病毒利用細胞機制進行複製的欺騙能力。他認為,通過研究病毒如何篡奪細胞功能為其服務,人們能獲得有關人體細胞複製機制的新知識。羅伯遜和他的同事表示,今後將研究其他的病毒是否同樣具有不藉助病毒蛋白質而進行複製的能力,並深入了解細胞引發病毒複製的機理。此外,為阻止病毒抑制免疫系統發展成疾病,研究人員還將在不阻斷細胞複製的前提下,尋求阻斷KSHV複製的途徑。
宿主細胞美國賓夕法尼亞大學醫學院研究人員表示,他們發現Kaposi肉瘤相關皰疹病毒(KSHV)能夠欺騙受其感染的細胞完成病毒遺傳物質複製。KSHV的這種複製手段能使其不被人體免疫系統察覺。過去,人們認為KSHV需要病毒蛋白質啟動複製,新的研究結果顯示病毒能夠獨立地從宿主細胞中獲取蛋白質實現自我複製。病毒通常由具有蛋白質外殼的遺傳物質組成,它通過穿透細胞膜並向細胞釋放大量的病毒遺傳物質而感染細胞。由於細胞為無性體,因此它們依賴複製蛋白質或宿主細胞的“機體”來複製自己的DNA物質。此前研究人員通過對受KSHV感染的人體細胞研究,確定了表示病毒遺傳物質開始複製的一個基因,它是病毒蛋白質———潛伏相關核抗原(LANA)的編碼基因,LANA同病毒DNA相束縛。為了解KSHV的複製是否完全依賴於LANA,研究人員採用了沒有LANA的宿主細胞。結果發現,KSHV的DNA能夠套用細胞複製機制自動複製。研究報告首席作者、微生物學教授爾樂?羅伯遜博士指出,病毒再一次打破了人們對細胞的認識模式,並向人們展現了病毒利用細胞機制進行複製的欺騙能力。他認為,通過研究病毒如何篡奪細胞功能為其服務,人們能獲得有關人體細胞複製機制的新知識。羅伯遜和他的同事表示,今後將研究其他的病毒是否同樣具有不藉助病毒蛋白質而進行複製的能力,並深入了解細胞引發病毒複製的機理。此外,為阻止病毒抑制免疫系統發展成疾病,研究人員還將在不阻斷細胞複製的前提下,尋求阻斷KSHV複製的途徑。 宿主細胞約翰霍普金斯的科學家在最新一期出刊的《公共科學圖書館•生物學》(PLoSBiololgy)期刊中,提出一個新的研究發現指出,愛滋病毒並非如科學界先前對逆轉錄病毒的看法,是利用宿主細胞上特定的膜上病毒輸送蛋白,進入感染的宿主細胞,反而是利用了宿主細胞本身就具有的輸送系統(transportsystem),而這個發現很可能在未來發展出打擊病毒的新策略。生物分子、藥物或病毒分子,是如何在細胞間傳遞,一直都是科學家所重視的焦點,因為一旦掌握特定分子的輸送機制,就可以調控相關的生理行為。以病毒來說,分析出病毒進出細胞的途徑,就等於掌握阻斷病毒傳播的方法。而過去對HIV這一類逆轉錄病毒而言,科學家一直認為它會透過特定的蛋白質受體入侵於釋出宿主細胞,然而這次約翰霍普金斯StephenGould博士的研究團隊,利用高倍率的顯微設備,觀察HIV病毒在人類T細胞上進出的過程,研究人員利用特定藥物分子的作用,觀察鎖定在細胞所釋出的膜狀泡囊exosomes身上,結果確實發現HIV利用這個細胞原本就存在的分泌系統,離開原先的宿主細胞,進而感染下一個目標,而且這個過程還利用到愛滋病毒身上的一個Gap蛋白。科學家懷疑這個就是愛滋病毒利用細胞既有的分泌系統,迅速擴張的原因之一,如今很可能可以針對相關的途徑設計出具有阻斷路徑的藥物,那么成功圍堵愛滋病毒的目標並非不可能實現。病毒究竟是如何將其DNA整合到宿主細胞內的一直是生物學的一個懸疑。現在,一項新研究表明病毒是通過將DNA控制在高壓力狀態來發射到宿主細胞內的。對於病毒而言,生活很容易,因為它們只需誘騙宿主細胞完成新病毒組裝的所有工作。但有一個艱巨的任務必需由病毒自己來完成,這就是將其DNA整合到宿主細胞內部的細胞核。細胞內的細胞質很濃,是蛋白質以及其它分子的鹽性混合物,因此插入一個DNA分子就像是在已經擁擠不堪的捷運車廂理擠出一條縫一樣困難。
宿主細胞約翰霍普金斯的科學家在最新一期出刊的《公共科學圖書館•生物學》(PLoSBiololgy)期刊中,提出一個新的研究發現指出,愛滋病毒並非如科學界先前對逆轉錄病毒的看法,是利用宿主細胞上特定的膜上病毒輸送蛋白,進入感染的宿主細胞,反而是利用了宿主細胞本身就具有的輸送系統(transportsystem),而這個發現很可能在未來發展出打擊病毒的新策略。生物分子、藥物或病毒分子,是如何在細胞間傳遞,一直都是科學家所重視的焦點,因為一旦掌握特定分子的輸送機制,就可以調控相關的生理行為。以病毒來說,分析出病毒進出細胞的途徑,就等於掌握阻斷病毒傳播的方法。而過去對HIV這一類逆轉錄病毒而言,科學家一直認為它會透過特定的蛋白質受體入侵於釋出宿主細胞,然而這次約翰霍普金斯StephenGould博士的研究團隊,利用高倍率的顯微設備,觀察HIV病毒在人類T細胞上進出的過程,研究人員利用特定藥物分子的作用,觀察鎖定在細胞所釋出的膜狀泡囊exosomes身上,結果確實發現HIV利用這個細胞原本就存在的分泌系統,離開原先的宿主細胞,進而感染下一個目標,而且這個過程還利用到愛滋病毒身上的一個Gap蛋白。科學家懷疑這個就是愛滋病毒利用細胞既有的分泌系統,迅速擴張的原因之一,如今很可能可以針對相關的途徑設計出具有阻斷路徑的藥物,那么成功圍堵愛滋病毒的目標並非不可能實現。病毒究竟是如何將其DNA整合到宿主細胞內的一直是生物學的一個懸疑。現在,一項新研究表明病毒是通過將DNA控制在高壓力狀態來發射到宿主細胞內的。對於病毒而言,生活很容易,因為它們只需誘騙宿主細胞完成新病毒組裝的所有工作。但有一個艱巨的任務必需由病毒自己來完成,這就是將其DNA整合到宿主細胞內部的細胞核。細胞內的細胞質很濃,是蛋白質以及其它分子的鹽性混合物,因此插入一個DNA分子就像是在已經擁擠不堪的捷運車廂理擠出一條縫一樣困難。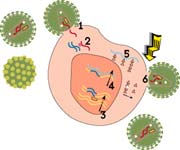 宿主細胞為查明細胞是否可能通過維持高壓力將DNA射到宿主細胞核內,加州大學洛山磯分校的分子生物學家AlexEvilevitch和他的同事設計了一組壓力測試。首先,他們將λ噬菌體--一種寄生於大腸桿菌的DNA病毒--放到含有大腸桿菌誘導λ噬菌體發射DNA的膜蛋白的溶液中。他們還逐漸提高溶液中一種惰性有機聚合體的濃度來增加滲透壓,直到達到病毒無法完全釋放其基因組的程度。通過量化不同濃度下病毒內殘留的DNA,科學家能夠確定λ噬菌體釋放DNA的難度,由此估測其內部壓力。
宿主細胞為查明細胞是否可能通過維持高壓力將DNA射到宿主細胞核內,加州大學洛山磯分校的分子生物學家AlexEvilevitch和他的同事設計了一組壓力測試。首先,他們將λ噬菌體--一種寄生於大腸桿菌的DNA病毒--放到含有大腸桿菌誘導λ噬菌體發射DNA的膜蛋白的溶液中。他們還逐漸提高溶液中一種惰性有機聚合體的濃度來增加滲透壓,直到達到病毒無法完全釋放其基因組的程度。通過量化不同濃度下病毒內殘留的DNA,科學家能夠確定λ噬菌體釋放DNA的難度,由此估測其內部壓力。這項研究的結果發表在本周美國《國家科學院院刊》(PNAS)的網路版上,揭示λ噬菌體是一個DNA“大炮”,其內部壓力約為大氣壓力的40倍,比香檳酒瓶內的壓力大約高10倍。巨大的壓力是由病毒蛋白質外殼內強大的DNA彎曲內部分子力產生的。這個研究結果與Lamda病毒需要多少壓力釋放內部DNA到宿主細胞的理論模型是一致的。這種方法可用於測定其它幾種病毒的內部壓力,包括RNA病毒。這個方法對於希望重新設計病毒用於藥物運送的研究人員也將會有幫助。西北大學的分子生物學家JonathanWidom稱這個研究結果十分令人信服,認為研究小組探索病毒“彈道學”的實驗方法“太棒了”。
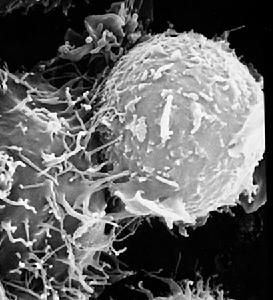 宿主細胞德國馬普傳染生物學研究所的CindyRechner等人發現,宿主糖蛋白Gp96和清道夫受體SREC在奈瑟氏淋球菌入侵時會特異性地與淋球菌的一些蛋白發生作用。奈瑟氏淋球菌感染宿主時會表達出許多蛋白質來調節細菌的粘附和入侵。Rechner研究的奈瑟氏淋球菌表達的血清A型主要外膜蛋白PorBIA取自於患有重症感染疾病的患者。在類似全身血液感染的低濃度磷酸鹽條件下,PorBIA能夠有效啟動侵襲細菌的粘附和侵襲作用。同時,Rechner等研究發現,人熱休克糖蛋白Gp96和清道夫受體SREC是PorBIA的特異性受體。奈瑟氏淋球菌表達的血清A型蛋白PorBIA(注意不是血清B型蛋白PorB)特異性地結合在宿主或重組的人熱休克糖蛋白Gp96上。宿主細胞Gp96的枯竭會阻止粘附,卻會有效引發奈瑟氏淋球菌的侵入。這種入侵會被化學抑制劑清道夫受體阻斷,清道夫受體SREC能夠特異性地阻斷PorBIA的侵入。因此,Rechner等人認為,宿主細胞中的熱休克糖蛋白Gp96可以抵抗奈瑟氏球菌的入侵,而清道夫受體SREC能夠介導宿主細胞的進入,從而阻斷細菌粘附和侵襲。
宿主細胞德國馬普傳染生物學研究所的CindyRechner等人發現,宿主糖蛋白Gp96和清道夫受體SREC在奈瑟氏淋球菌入侵時會特異性地與淋球菌的一些蛋白發生作用。奈瑟氏淋球菌感染宿主時會表達出許多蛋白質來調節細菌的粘附和入侵。Rechner研究的奈瑟氏淋球菌表達的血清A型主要外膜蛋白PorBIA取自於患有重症感染疾病的患者。在類似全身血液感染的低濃度磷酸鹽條件下,PorBIA能夠有效啟動侵襲細菌的粘附和侵襲作用。同時,Rechner等研究發現,人熱休克糖蛋白Gp96和清道夫受體SREC是PorBIA的特異性受體。奈瑟氏淋球菌表達的血清A型蛋白PorBIA(注意不是血清B型蛋白PorB)特異性地結合在宿主或重組的人熱休克糖蛋白Gp96上。宿主細胞Gp96的枯竭會阻止粘附,卻會有效引發奈瑟氏淋球菌的侵入。這種入侵會被化學抑制劑清道夫受體阻斷,清道夫受體SREC能夠特異性地阻斷PorBIA的侵入。因此,Rechner等人認為,宿主細胞中的熱休克糖蛋白Gp96可以抵抗奈瑟氏球菌的入侵,而清道夫受體SREC能夠介導宿主細胞的進入,從而阻斷細菌粘附和侵襲。宿主排除病原體方式
宿主排出病原體的方式可有多種。常見於呼吸道、消化道、皮膚和血液(吸血昆蟲叮咬)。其排出途徑決定於侵入門戶、病原體的特異性定位和可能的傳播條件
 宿主細胞
宿主細胞 宿主細胞
宿主細胞 宿主細胞
宿主細胞 宿主細胞
宿主細胞 宿主細胞
宿主細胞