介紹
基因編程,是一項先進的生物基因改良技術,美國於二十一世紀初期於紐約州立大學,SUNY Albany Mohawk Tower suite 2013 建立其部門進行相關研究。 這門技術顧名思義原理與電腦編程相像,將人類基因代碼公式化,進行編輯及重組,並以“人體”執行其程式代碼。負責人稱,如果研發順利,未來二十年內可自由更換人類的瞳孔顏色或形狀,對人體某些器官進行改良,甚至可以進行 CCR5-delta32 人工突變使人體對愛滋病病毒免疫。
意義
基因編程的意義不僅於此。地球上的物種所使用的是同一套基因程式系統,那么,解讀人類基因程式語言更重要的意義在於解讀地球生物圈的程式代碼。這對研究物種誕生之緣有著重要意義,當然我們不排除“人造”地球生物圈的可能性。如果把地球的生物圈當作一個生物進化的實驗工廠,那么在宇宙其他適宜星球建立的實驗工廠可能使用有別於地球的程式語言。我們自己的程式語言代碼是文明溝通的極佳工具。當人類最終理解自身的基因程式語言時,那意味著人類也具有創造以新程式語言為基礎的生物圈系統。
當基因編程成功,人類將有機會獲得動物、植物的非公式性變數波動(即情感波動),那么也可以理解動物的語言(如果他存在),通過這些,就可以探索幾個未解之謎,揭開整個歷史的面紗。
進程
勞倫斯伯克利國家實驗室(Berkeley Lab)的科學家發現了一種更有效的基因組編輯新方法,為基因工程和基因組研究者帶來了福音。基因工程改造的微生物(如細菌和真菌)在生物能源和藥物研發等方面起到了關鍵作用,而這一研究成果能為科學家提供極大的幫助。
勞倫斯伯克利國家實驗室的研究團隊發現了一種雙鏈RNA,能指導細菌蛋白在特定位點剪下外源DNA,而且將這種雙鏈RNA改造為單鏈RNA,能指導細菌蛋白對幾乎所有DNA序列進行剪下。該文章發表在Science雜誌上。
研究人員發現的這種RNA引導的雙鏈DNA剪下是細菌獲得性免疫系統的核心。細菌和古細菌面臨著病毒和質粒的不斷攻擊,微生物為了生存採用了以CRISPR(成簇的規律間隔的短回文重複序列)為核心的免疫系統。細菌和古細菌能夠利用小crRNA分子(CRISPR-derived RNA),結合CRISPR和相關內切酶Cas蛋白(CRISPR-associated蛋白)靶標並摧毀入侵病毒和質粒的DNA。
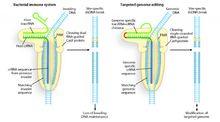 基因改造
基因改造CRISPR/Cas免疫系統主要有三種類型。這裡研究人員研究的是完全依賴Cas9內切酶家族來靶標和剪下外源DNA的II型CRISPR/Cas免疫系統。研究發現在這一系統中,crRNA通過鹼基配對與tracrRNA(trans-activating RNA)結合,形成雙鏈RNA。這一tracrRNA:crRNA二元複合體指導Cas9蛋白在crRNA引導序列靶標的特定位點剪下雙鏈DNA。在與crRNA引導序列互補的位點,Cas9蛋白的HNH核酸酶結構域剪下互補鏈而Cas9 RuvC-like 結構域剪下非互補鏈。(見右圖)
研究人員將這種tracrRNA:crRNA二元複合體改造為單鏈RNA嵌合體,也能同樣指導Cas9蛋白在特定位點剪下雙鏈DNA。tracrRNA:crRNA複合體結合Cas9蛋白,並通過crRNA與目標DNA鹼基配對引導Cas9蛋白到特定DNA序列,微生物通過這一機制剪下並破壞病毒和質粒,而這一系統也可以用於對基因組中目標DNA進行改造。
研究人員正在深入研究這一RNA引導的剪下作用的細節,並測試這一系統是否能在真菌、線蟲、植物和人類細胞等真核生物中起作用。
這一機制有望成為有效的基因組改造新工具,可程式RNA引導的基因組改造為基因組編輯開闢了新途徑。
可程式的DNA剪刀:細菌免疫系統發現的雙鏈RNA指導Cas9在特異位點剪下入侵DNA。人為改造這一雙鏈RNA,可以用於進行基因組編輯。
Science雜誌原文摘要:
A programmable dual RNA-guided DNA endonuclease in adaptive bacterial immunity
CRISPR/Cas systems provide bacteriaand archaea with adaptiveimmunityagainst viruses and plasmids by using crRNAs to guide the silencing of invading nucleic acids. We show here that ina subset of these systems, the mature crRNA base-paired to trans-activating tracrRNA forms a two-RNA structure that directs the CRISPR-associated protein Cas9 to introduce double-stranded (ds) breaks in target DNA. At sites complementary to the crRNA-guide sequence, the Cas9 HNH nuclease domain cleaves the complementary strand while the Cas9 RuvC-like domain cleaves the noncomplementary strand. The dual-tracrRNA:crRNA, when engineered as a single RNA chimera, also directs sequence-specific Cas9 dsDNA cleavage. Our study reveals a family of endonucleases that use dual RNAs for site-specific DNA cleavage and highlights the potential to exploit the system for RNA-programmable genome editing.

