定義
均相反應是指所有參加反應的物質均處於同一相內的化學反應,它不存在相間傳質 。儘管在反應體系的不同空間位置上物料濃度可能有相當大的差異,但就其中的任意一個微分體積來說,反應物、反應產物、溶劑和催化劑都可以認為是均勻分布的。
若是反應體系為均一的氣相,該反應稱為氣相均相反應,如低級烴的熱裂解反應;若反應體系是均一的液相,則反應稱為液相均相反應,如無機酸鹼中和反應。在工程中,往往考慮兩個方面來判斷是否為均相反應,即兩種或兩種以上的反應物之間是否可以互溶,或者各個反應物均可溶解於某個反應介質中,只要能使反應體系達到分子尺度上的均勻,都可以認為是均相反應。
但可能在實際的操作上,我們還需要考慮到工程中的實際問題,其中主要的就是預混合時間問題。所謂預混合,就是指在反應之前將反應物混合到分子尺度的過程。但是在預混合時間內,反應已經開始,所以預混合時間與反應時間之間的長短可直接影響到反應體系是否確實為均相反應。若預混合時間相對於反應時間來說很短,預混合時間中進行的反應可忽略不計,整個反應是均相反應。反之,反應進行得極快,在預混合時間內反應就完成了,那么,反應就在沒有達到分子尺度上的均一的時候就已經完成,就不能認為是均相反應。所以在實際工程中,均相反應需要滿足反應體系可以成為均相和預混合時間遠小於反應的時間兩個條件 。
均相反應動力學
反應速率方程也稱反應動力學方程。均相反應的速率取決於物料的濃度和溫度,這種關係的定量表達式就是動力學方程 。
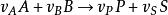 均相反應
均相反應對於不可逆反應: ,動力學方程為:
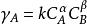 均相反應
均相反應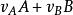 均相反應
均相反應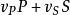 均相反應
均相反應對於可逆反應: ⇌ ,其動力學方程為:
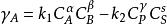 均相反應
均相反應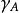 均相反應
均相反應式中: —為物質A的反應速率;
α、β—分別為A、B的反應級數;
k—反為反應速率常數;
k、k—分別為正、逆反應速率常數
C—為物質的濃度。
均相反應器
常見的均相反應器主要有以下幾類 :
(1)間歇釜式反應器。
攪拌釜式反應器是一種最常見的間歇反應器。頂部有一攪拌器,以使釜內物料混合均勻,頂蓋上有多個管口,用於加入反應物料或測量溫度、壓力等。有些在簡體外部裝有夾套用來加熱或冷卻,還有些在反應器內設盤管以增大傳熱面積。歇反應器一般適用於一些反應時間較長的慢反應。由於其靈活、簡便,在小批量、多品種的染料、醫藥等行業有廣泛的套用。
(2)平推流反應器。
平推流反應器中物料的流動滿足這樣的假定:即通過反應器的物料沿著同一方向以相同的速度向前流動。因此,平推流反應器內所有物料的停留時間均相同。
(3)全混釜式反應器。
全混釜式反應器在型式上和間歇釜式反應器相似,所不同的是間歇釜是間歇操作,而全混釜是連續進出料。
(4)循環反應器。
將其出口物料的一部分循環到反應器入口,即成為循環操作的平推流反應器。
(5)反應器的組合。
由不同流動模式(平推流、全混流、循環流)的反應器以不同的連線方式(串聯、並聯、串並聯)組合而成的反應系統。對於不同特性的反應,不同的反應器組合會有不同的結果。

