概述
 國食健字
國食健字2003年,原由衛生部承擔的保健食品審批職能劃轉國家食品藥品監督管理局。同年10月,國家食品藥品監督管理局正式啟動了保健食品受理審批工作。目前,保健食品的質量標準由國家質量監督檢驗檢疫總局頒布,保健食品的生產和市場監督由衛生部等部門負責。
2003年10月23日15:25 【粵港信息日報】稱:昨天,記者從國家食品藥品監督局(SFDA)獲悉,關閉了近半年的保健食品審批大門本月又重新開啟。1019個從衛生部移交到SFDA的已受理但尚未完成審批工作的保健食品註冊申請,將於12月之前全部審批完畢。而從10月10日開始新受理的品種,將於12月啟動審批工作,預計明年2月份完成審批工作。另據SFDA藥品註冊司司長謝曉於透露,保健食品有關法規的修訂工作也將於明年初啟動。
據悉,衛生部原承擔的保健食品審批職責已劃轉國家食品藥品監督局。目前,兩部門的職責移交工作已經基本完成。今後國家頒發的保健食品審批批准證書為“國食健字”。
謝曉於表示,此次,衛生部移交過來的1019個待批品種中,參加評審大會但沒有完成的有492個;已經受理但沒有參加評審大會評審技術審批工作的一共398個;完成技術評審待行政批准的38個。所有品種都會在11月中旬收到SFDA的評審意見,12月之前全部評審完畢。而10月10日以後新受理的品種目前已有近百個。
至於申請企業所關心的保健食品審批轉移到SFDA後的手續、技術要求有何不同?謝曉於表示,在現行有關規定未作出修改之前,依然執行原衛生部頒布的規定。有關技術審批的工作依然由原衛生部評審專家評審,衛生部出具的檢驗報告在沒有重新論證之前依然有效。
此前,各省的保健品申報都需要地方相關部門初審,對此,謝曉於表示,由於省級藥監部門改革要到明年初才到位,為了不影響申報工作,暫由國家直接受理。但她強調,不需要地方初審並不等於取消初審。由SFDA直接接受初審。
謝曉於透露,明年初修訂完善保健食品的有關法規工作將啟動。SFDA為完善法規將進行全面調研。另外,SFDA還將就保健食品批號換證摸底普查。過去的“衛食健字”轉由SFDA審批後文號改為“國食健字”。
申報流程
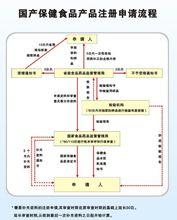 國食健字批文申辦流程
國食健字批文申辦流程保健食品申報主要涉及以下四種機構:
檢測機構:接受企業的委託,負責對產品進行技術檢驗,並出具檢驗報告。具體為各省、直轄市的疾病控制中心(或衛 生防疫站) 、中國 CDC 食品衛生監督檢驗所、中國預防醫學科學院、以及部分醫學院校。
受理辦:包括省藥監局受理處和國家藥監局保健食品評審中心。負責對企業的申報材料進行初步審核,材料符合要求則,負責安排產品參加評審會;將評審意見通知企業;對於擬批准的產品上報行政部門審批;發放證書等。
評審委員會:國家藥監局保健食品評審中心同時負責組織專家對申報的產品進行技術評審。
行政部門:國家藥監局註冊司對評審委員會技術評審的產品進行審核,如符合有關法規的規定,則予以批准。
申報周期
國食健字的註冊周期是指從企業法人提出註冊申請、提交申報資料開始到取得保健食品批准證書的時間。申請人進行產品研製、樣品試驗和申報資料的編寫的時間不包括在註冊時間內。國家食品藥品監督管理局頒布《保健食品註冊管理辦法(試行)》的規定,申報資料的審核受理時限為5個工作日,試驗和試製現場核查時限為15個工作日,技術審評和行政審查時限為80個工作日(在技術審評的同時進行樣品檢驗,時限為50個工作日)。一個產品的註冊時限為100個工作日,即少於5個月的時間。但是值得注意的是,少於5個月的時間是指在申請人提交的申報資料完全符合要求,不需要補充任何申報資料的情況下,如申請人提交的申報資料不完全符合要求,需要補充提交一次或多次申報資料的,其註冊時間會相應延長。如果要補充一次申請資料,則審查期限上要給與延長至少一個月的時間。

