固體的內聚能
正文
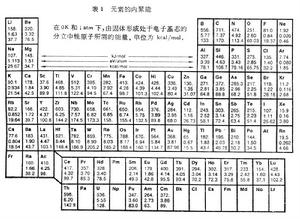
分散的原子結合成固體時釋放出的能量W。表1列出實驗測得的各元素的內聚能。表2列出一些離子晶體的內聚能。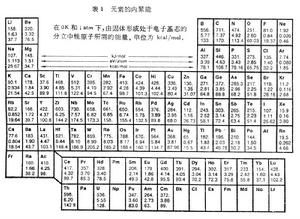 固體的內聚能
固體的內聚能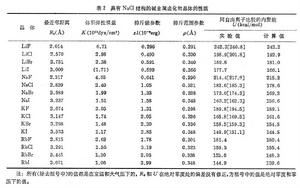 固體的內聚能
固體的內聚能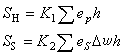 。 (1)
。 (1)
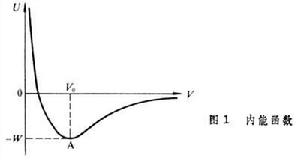 固體的內聚能
固體的內聚能惰性元素晶體 這類元素的電子殼層都是完滿封閉的,每個原子就是一個分子,在固態組成簡單的密堆積六角或面心立方結構的分子晶體。晶體的內能由各對原子之間的相互作用勢能的總和決定。每對原子間的勢能有兩項,一項是分子間的范德瓦耳斯吸引勢,它與惰性原子之間的距離 R的六次方成反比。另一項是由兩原子的電子波函式重疊而引起的排斥勢,近似正比於T-12。所以可以把它寫為
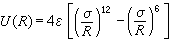 , (2)
, (2)
 固體的內聚能
固體的內聚能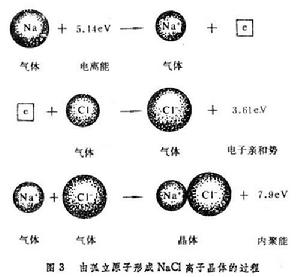 固體的內聚能
固體的內聚能(7.9+3.6-5.1)=6.4 (電子伏/分子)。
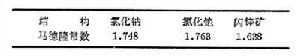
與表相比較,可以看到這比元素Na和Cl的固體內聚能的總和大得多。從理論上估計離子組成晶體時的相互作用能有兩項:一項是離子間的庫侖作用勢,它包含同號離子的排斥勢和異號離子的吸引勢,以NaCl結構為例,可以寫成
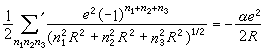 , (3)
, (3)
 固體的內聚能
固體的內聚能除去庫侖勢外,還要考慮到相鄰離子的電子波函式重疊而引起的排斥勢。它通常用以下經驗公式來描述:
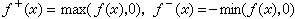 , (4)
, (4)
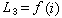 , (5)
, (5)
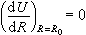 , (6)
, (6)
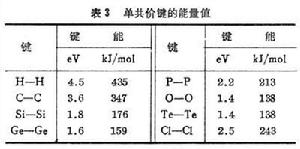
共價晶體 電負性較強,而有外電子殼層未滿的原子,如ⅣA-ⅥA族元素,往往結成共價晶體(或稱為同極晶體)。相鄰的兩個原子各出一個電子,組成一對為兩個原子所共有的電子。這兩個電子自鏇相反,在兩個原子核之間的區域有較大的密度,起到同時吸引兩個核的作用,把它們結合起來。這種電子結構稱為共價鍵,是一種很強的鍵合。表3列出幾種典型的共價鍵的單鍵結合能量。
 固體的內聚能
固體的內聚能金屬晶體 電負性比較小的原子(如ⅠA, ⅡA, ⅢA,ⅠB, ⅡB,ⅢB族絕大多數元素)結合成固體時,形成金屬性晶體。這時原來分屬於各個原子的價電子為整個晶體所“共有”。也就是說,價電子不再束縛在特定的原子上或某些相鄰原子之間,而是在整個晶體內運動,它們的波函式遍及整個晶體。金屬的高導電性、導熱性和金屬光澤,都和共有化價電子可以在整個晶體內自由運動相關。
金屬晶體內聚能主要是靠共有化價電子所形成的充塞於整個晶體的負電荷海,和浸在這海中的失去了價電子的離子實構成的正電荷點陣之間的庫侖吸引作用。顯然,晶體的摩爾體積愈小,負電荷與正電荷的密度就愈大,這種庫侖作用能Uσ也愈低。
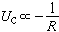 。但是另一方面,隨著共有化電子密度的增加,它們的平均動能也增加,動能
。但是另一方面,隨著共有化電子密度的增加,它們的平均動能也增加,動能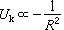 ,這相當於一種排斥作用。另外當相鄰的離子實接近到其電子云顯著重疊時,它們之間也有如式(4)所表示的排斥作用能。考慮聚合作用與排斥作用互相平衡時的能量極小值,可以得出金屬的內聚能。
,這相當於一種排斥作用。另外當相鄰的離子實接近到其電子云顯著重疊時,它們之間也有如式(4)所表示的排斥作用能。考慮聚合作用與排斥作用互相平衡時的能量極小值,可以得出金屬的內聚能。 因為金屬結合主要是一種體積性的庫侖作用,不具方向性,而離子實之間的重疊排斥又和硬球相似,所以大多數金屬晶體都採取原子球密堆積的結構,如面心立方、六角密堆積結構等。
除上面簡述的四種典型的晶體結合方式,通常還有一種氫鍵結合。在某些條件下,氫原子可以在兩個電負性較強的原子(如F、O和N)之間形成特殊的結合。在極端的情況氫鍵是離子性的,氫原子失去它的電子,交給分子中另一個原子,這個裸露的質子構成氫鍵。氫鍵內聚能約為0.1電子伏特。
許多實際固體的結合往往兼有上述兩種或多種結合的特點,分析它們的內聚能就更複雜些,需要綜合上述原理來考慮。應該指出,近年來套用大型電子計算機,在能帶理論和電子氣理論的基礎上,可以具體計算晶體的內聚能。已經對大部分元素晶體和某些化合物晶體得到相當符合實驗值的結果。