基本信息
中文名稱:四氧化三鐵
中文別名:磁性氧化鐵;四氧化三鐵磁性納米微球;
英文名稱:ferrosoferric oxide
英文別名:Iron(II) diiron(III) oxide;Fe NP NH2,FexOy,Magnetic iron oxide nanocrystals;
Fe NP COOH,FexOy,Magnetic iron oxide nanocrystals;Triiron Tetraoxide;Iron(II,III)oxide;
CAS號:1317-61-9
分子式:FeO
分子量:231.53300
精確質量:231.78400
安全信息
符號:GHS02GHS07GHS08GHS09
信號詞:危險
危害聲明:H225; H304; H315; H336; H361d; H373; H411
警示性聲明:P210; P261; P273; P281; P301 + P310; P331
海關編碼:2821100000
危險品運輸編碼:UN 1294 3/PG 2
危險類別碼:R36/37/38
安全說明:S26; S36/37/39; S62; S46; S36/37
危險品標誌:Xn; Xi; F
結構
鐵元素的三種氧化物:氧化亞鐵(FeO)、氧化鐵(FeO)、四氧化三鐵(FeO)。
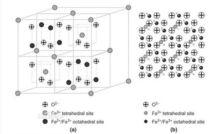
四氧化三鐵是中學階段唯一可以被磁化的鐵化合物。四氧化三鐵中含有Fe 和Fe ,X射線衍射實驗表明,四氧化三鐵具有反式尖晶石結構, 晶體 中從來不存在偏鐵酸根離子FeO。四氧化三鐵,又稱磁性氧化鐵、氧化鐵黑、磁鐵、磁石、吸鐵石,天然礦物類型為磁鐵礦。鐵在四氧化三鐵中有兩種化合價,為反式尖晶石結構,即[ FeⅢ]t[FeⅢFeⅡ]oO,氧做立方最密堆積。另外,四氧化三鐵還是導體,因為在磁鐵礦中由於Fe 與Fe 在八面體位置上基本上是無序排列的,電子可在鐵的兩種氧化態間迅速發生轉移,所以四氧化三鐵固體具有優良的導電性。 FeO可以看成FeO·FeO這種寫法較好說明了FeO中含有Fe(Ⅱ)和Fe (Ⅲ)。缺點是這種類似復鹽的化學式寫法容易使學生誤認為FeO是混合物(或固溶體)。此外,這並不能表明FeO的真實結構。
理化性質
物理性質
黑色的FeO是鐵的一種混合價態氧化物,熔點為1597℃,密度
 四氧化三鐵
四氧化三鐵為5.17g/cm ,不溶於水,可溶於酸溶液,在自然界中以磁鐵礦的形態出現,常溫時具有強的亞磁鐵性與頗高的導電率。
(也有文獻指出FeO的熔點為1538℃,不溶於酸)
鐵磁性和亞鐵磁性物質在Curie溫度以上發生二級相變轉變為順磁性物質。FeO的Curie溫度為585℃。
可將物質的磁性分為五類:
(a) 抗磁性(反磁性):物質中全部電子在原子軌道或分子軌道上都已雙雙配對、自鏇相反,沒有永久磁矩。
(b) 順磁性:原子或分子中有未成對電子存在,存在永久磁矩,但磁矩間無相互作用。
(c) 鐵磁性:每個原子都有幾個未成對電子,原子磁矩較大,且相互間有作用,使原子磁矩平行排列。
(d) 亞鐵磁性(鐵氧體磁性):相鄰原子磁矩部分呈現不相等的反平行排列。
(e) 反鐵磁性:在Néel溫度以上呈順磁性;在低於Néel溫度時,磁矩間相鄰原子磁矩呈現相等的反平行排列。
FeO有高的電導率,可以將FeO不平常的電化學性質歸因於電子在Fe 與Fe 之間的傳遞。
化學性質
鐵絲在氧氣里燃燒會生成四氧化三鐵,比較鐵的氧化物的標準摩爾生成Gibbs自由能的大小,得出FeO的熱力學穩定性最大,因此產物是FeO。
鐵與空氣接觸就會在其表面上形成氧化物,此時,氧化物膜本身的化學組成並非均勻。如一塊低碳鋼可以為三種氧化物膜所覆蓋:與金屬接觸的是FeO,與空氣接觸的一側是FeO,中間則是FeO更確切地說,也許是三種氧化物的飽和固溶體的混合物構成鋼鐵表面的氧化膜層。
同時,氧化物膜的厚度也視氧化時的不同環境條件而變化。室溫下,乾燥空氣中相對較純的鐵上氧化物的厚度不超過20埃(1埃=0.1納米)但在潮濕空氣中氧化物膜的厚度明顯增加,可以看到表面上的銹斑。此時氧化物的沉積是分層的,接近金屬的一側是緻密的無定形無水層,接近空氣一側是厚的多孔水化層。
鐵與水蒸氣反應生成FeO和氫氣
FeO有抗腐蝕效果,如鋼鐵製件的發藍(又稱燒藍和烤藍)就是利用鹼性氧化性溶液的氧化作用,在鋼鐵製件表面形成一層藍黑色或深藍色FeO薄膜,以用於增加抗腐蝕性、光澤和美觀。
常見化學反應
1.在高溫下,易氧化成氧化鐵。4FeO+O=高溫=6FeO
2.在高溫下可與還原劑CO、Al、C等反應。3FeO+8Al=高溫=4AlO+9Fe
3.FeO+4CO=高溫=3Fe+4CO
4.在加熱條件下可與還原劑氫氣發生反應。FeO+4H=△=3Fe+4HO
5.二氧化氮和灼熱的鐵粉反應生成四氧化三鐵和氮氣3Fe+2NO=高溫=FeO+N
6.鐵在氧氣中燃燒生成四氧化三鐵 3Fe+2O=點燃=FeO
7.熾熱的鐵和水蒸氣反應生成四氧化三鐵 3Fe+4HO(g)=高溫=FeO+4H
8.和酸反應 FeO+8HCl=FeCl+2FeCl+4HO
 鐵絲在氧氣中燃燒
鐵絲在氧氣中燃燒生產方法
α-氧化鐵的氫氣還原法
將高純微粉狀α-FeO裝入盤中,粉末層不應過厚。將盤放入反應管之後,通入高純氮氣將空氣完全置換出去。接著通過洗氣瓶慢慢送入經水飽和的氫氣。加熱溫度在300~400℃(例如330℃)比較適當。確證反應完了(通常1~3h)後冷卻,停止送氫氣,再用氮氣置換之後,取出樣品。水蒸氣量不足,加熱溫度過高或還原過度都會生成FeO,因此必須注意。提高洗氣瓶溫度就可以增加水蒸氣量(40~60℃比較適宜)。以針狀α-FeO(OH)為起始原料經加熱脫水則得α-FeO。用這種α-FeO就可製得針狀四氧化三鐵粒子。黑色錄音磁帶就是用這種四氧化三鐵作為磁帶錄音媒介。
加合法
將鐵屑與硫酸反應製得硫酸亞鐵,再加入燒鹼和氧化鐵在95~105℃進行加合反應生成四氧化三鐵,經過濾、烘乾、粉碎製得氧化鐵黑。
氫氧化亞鐵的緩慢氧化法
將含有氫氧化亞鐵沉澱的水溶液加熱到70℃以上,進行緩慢的氧化,就可以得到由棱長大約0.2μm的相當均勻的正八面體或立方單晶粒子組成的四氧化三鐵粉末。也可以用輸送空氣泡作為氧化的手段。還可以用像KNO那樣的氧化劑。
Harber法
操作熟練的話可以得到化學計算組成為FeO的四氧化三鐵,Harber法將220g 20%氨水加到2.2L FeSO·7HO水溶液,在斷絕空氣的條件下煮沸(可以用裝有毛細管的圓底燒瓶),在煮沸中加入含有25.5g KNO的濃水溶液。
加鹼法
硫酸亞鐵溶液加鹼氧化或將鐵鹽和亞鐵鹽的溶液按一定比例混合後加鹼沉澱製得。
儲存方式
儲存注意事項:貯存於通風,乾燥的庫房中。包裝應密封、防潮。避免高溫,並與酸、鹼物品隔離存放。
用途
•四氧化三鐵是一種常用的磁性材料。
•特製的純淨四氧化三鐵用來作錄音磁帶和電訊器材的原材料。
•天然的磁鐵礦是煉鐵的原料。
•用於制底漆和面漆。
•四氧化三鐵是生產鐵觸媒(一種催化劑)的主要原料。
•它的硬度很大,可以作磨料。已廣泛套用於汽車制動領域,如:剎車片、剎車蹄等。
•四氧化三鐵在國內焊接材料領域已得到認可,用於電焊條、焊絲的生產尚屬起步階段,市場前景十分廣闊。
•四氧化三鐵因其比重大,磁性強的特點,在污水處理方面表現出了良好的性能。
•四氧化三鐵還可做顏料和拋光劑。
•我們還可以通過某些化學反應,比如使用亞硝酸鈉等等,使鋼鐵表面生成一層緻密的四氧化三鐵,用來防止或減慢鋼鐵的鏽蝕,例如槍械、鋸條等表面的發藍、發黑。俗稱“烤藍”。
•製作特殊電極。
納米級別
簡介
四氧化三鐵具有鐵磁性,如果形成顆粒半徑在納米級別,稱為四氧化三鐵磁性顆粒。
反應原理
2013來,有關納米FeO製備的文獻大量湧現,一些新型的製備工藝也不斷出現。傳統製備納米FeO的方法主要有沉澱法、水熱(溶劑熱)法、微乳化法、溶膠-凝膠法。新興的製備方法如微波法、熱解羰基前軀體法、超聲法、空氣氧化法、熱解-還原法、多元醇還原法等正逐漸成為學者們研究的熱點。在相關製備FeO的方法中,新型的表面活性劑、製備體系也都有所突破。表面活性劑已經不僅僅局限於SDS、PEG、CTAB、檸檬酸、油酸等,用NSOCMCS、聚丙烯醯胺作修飾劑也有於報導。製備體系也相繼出現乙醇-水體系、正丙醇-水、丙二醇-水體系等。
1、 沉澱法
沉澱法由於其工藝操作簡單成本較低,產品純度高,組成均勻,適合於大規模生產,成為最常用的納米顆粒的製備方法。同時,通過向沉澱混合液中加入有機分散劑或絡合劑可提高納米粒子的分散性,克服納米粒子易團聚的缺點。常用的沉澱法有共沉澱法、水解沉澱法、超聲沉澱法、醇鹽水解法和螯合物分解法等。
(1) 共沉澱法
 共沉澱原理
共沉澱原理共沉澱法在含有多種陽離子的溶液中加入沉澱劑,讓所有離子完全沉澱。為了獲得均勻的沉澱,通常將含有多種陽離子的鹽溶液慢慢加入到過量的沉澱劑中進行攪拌,使所有離子的濃度大大超過沉澱的平衡濃度,儘量使各組分按比例同時析出來。
其原理是Fe +2Fe +8OH →FeO+4HO。具體如右圖。
沉澱法製備納米粒子時,Fe 、Fe 的摩爾比直接影響產物的晶體結構;溶液的pH值、離子濃度、反應溫度等均影響微粒的尺寸大小。如何通過控制反應條件製備晶體結構單一、顆粒尺寸均勻的納米顆粒是沉澱法所面臨的主要問題。外沉澱劑的過濾、洗滌也是必須考慮的問題。
共沉澱法得到的四氧化三鐵納米粒子多為球形結構,粒徑較小(5~10nm)。但由於該反應的溫度比較低,所以得到的粒子的結晶性相對較差。而且,該法製備的納米FeO微粒沉澱在洗滌、過濾和乾燥時顆粒間易發生團聚,會影響納米FeO的性能。
(2) 水解沉澱法
水解沉澱法就是利用鹼性物質的水解釋放OH ,常用的鹼性物質有尿素、己二胺等,這些物質釋放OH 的速度比較慢,在製備納米FeO微粒時有利於生成顆粒均勻的納米顆粒,通常這種方法能製備出顆粒分布在7nm到39nm的納米顆粒。
(3) 超聲沉澱法
超聲能在溶劑中產生空化效應,產生的空化氣泡在10~11秒的極短時間內塌陷,泡內產生5000K左右的高溫。該系列空化作用與傳統攪拌技術相比更容易實現介觀均勻混合,消除局部濃度不均,提高反應速度,刺激新相的形成,而且對團聚還可以起到剪下作用,有利於微小顆粒的形成。超音波技術的套用對體系的性質沒有特殊的要求,只要有傳輸能量的液體介質即可。Vijayakumar.R等用高強度超音波的輻射,從乙酸鐵鹽水溶液製得粒徑為10nm,具有超順磁性的FeO顆粒。
(4) 醇鹽水解法
利用醋酸鈉在水中電離生成醋酸根的還原作用,在高壓反應釜中180℃左右將Fe部分還原Fe,Yonghui Deng等用FeCl₃醋酸鈉和乙二醇在高壓反應釜中加熱200℃8h即製得了具有超順磁性的FeO納米顆粒。
(5) 螯合物分解法
該法原理是金屬離子與適當的配體形成常溫穩定的絡合物,在適宜的溫度和pH值時絡合物被破壞,金屬離子重新釋放出來與溶液中的OH 離子及外加沉澱劑、氧化劑作用生成不同價態不溶性的金屬氧化物、氫氧化物、鹽等沉澱物,進一步處理可得一定粒徑甚至一定形態的納米粒子。
2、水熱(溶劑熱)法
水熱(溶劑熱)反應是高溫高壓下在水溶液(有機溶劑)或蒸氣等流體中進行的有關化學反應的總稱。水熱法是近十餘年發展起來的一種製備納米粉體的合成,用此法所製備的FeO粒徑小、粒度較均勻、不需要高溫煅燒預處理,並可實現多價離子的摻雜。然而,由於水熱法要求使用耐高溫、高壓的設備,因而此法成本較高,難以實現規模化生產。
水熱法製備納米FeO大多採用無機鐵鹽(FeCl·6HO、FeCl·4HO、FeSO)和有機鐵鹽(二茂鐵Fe(CH))作為先驅體,以聯氨、聚乙烯基乙二醇、PVP等作為表面活性劑,在低於200℃的鹼性溶液條件下合成。
Shouheng Sun用水熱方法製備了粒徑可控的超順磁性FeO顆粒。首先以Fe(acac)為Fe源製備粒徑為4nm的FeO顆粒,然後以粒徑為4nm的FeO顆粒為晶種,通過控制保溫時間等因素分別製備了粒徑分別為6、8、12、16nm的FeO納米顆粒。
Zhen Li等報導了採用常見的FeCl·HO替代價格昂貴的Fe(acac)作為前驅體,製備了FeO納米顆粒。
Yadong Li等報導了以FeCl·6HO、NaAC、EG、PEG為原料製備了單分散性的FeO納米顆粒,且粒徑尺寸可調。
3、微乳化法
微乳化法是指兩種互不相溶的溶劑在表面活性劑的作用下形成乳液,也就是雙親分子將連續介質分割成微小空間而形成微型反應器,反應物在其中反應生成固相,由於成核、晶體生長、聚結、團聚等過程受到微反應器的限制,從而形成包裹有一層表面活性劑並且有一定凝聚態結構和形態的納米顆粒。
微乳液法製備納米催化劑,具有所需設備簡單、實驗條件溫和、粒子尺寸可控等優點,這是其它方法所不能比擬的。因此,成為納米催化劑合成中令人十分關注的技術。關於微乳液法製備納米催化劑方法的研究多集中於對粒子尺寸的控制上,關於對粒子單分散性的控制研究還比較少。
4、溶膠-凝膠法(sol-gel)
該法是利用金屬醇鹽的水解和聚合反應製備金屬氧化物或金屬氫氧化物的均勻溶膠,再濃縮成透明凝膠,凝膠經乾燥熱處理後製得氧化物超微粉的。Sol-gel方法的缺點是採用金屬醇鹽作為原料致使成本偏高,且凝膠化過程合成周期長。同時,套用sol-gel法製備粒徑100nm以下的納米顆粒還未見報導。
此外,其它製備方法如微波法、熱解羰基前軀體法、超聲法、空氣氧化法、熱解-還原法、多元醇還原法等相繼有報導。
海岩冰等用FeSO溶液加入氨水溶液在微波爐中8s即得到黑色的FeO納米顆粒。Alivasatos等用熱解羰基前軀體法製備出了單分散的γ-FeO納米粒子,此後該法在製備單分散的磁性氧化物納米粒子中得到了廣泛的套用。Liu等採用多元醇還原法,利用乙醯丙酮亞鐵和乙醯丙酮合鉑在高溫液相中的還原反應製取了直徑為3nm的FePt磁性納米粒子,該粒子在表面活性劑的保護下呈現單分散狀態。孟哲等人在室溫下pH=10左右的環境中採用氧化誘導、空氣氧化Fe(OH)懸浮液成功製備出高純度、磁性強、球形分布的FeO超細粉體。
套用
在當代電氣化和信息化社會中,磁性材料的套用非常廣泛。四氧化三鐵磁性材料作為一種多功能磁性材料,在腫瘤的治療、微波吸收材料、催化劑載體、細胞分離、磁記錄材料、磁流體、醫藥等領域均已有廣泛的套用,這種材料很有發展前景。
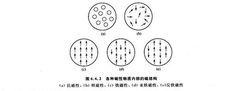 各種磁性物質內部的磁結構
各種磁性物質內部的磁結構
