正文
單分子反應主要指氣相中單一反應物分子的離解和異構化反應。早期的實驗測得這類反應在氣體壓力較高時屬一級反應,而當壓力降到很低時轉變為二級反應。為了解釋上述實驗結果和探討單分子反應所需能量的由來,發展了單分子反應理論。
林德曼-欣謝爾伍德理論1922年F.A.林德曼首先提出了以碰撞激發為基礎的單分子反應的簡單模型:
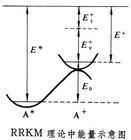
 單分子反應理論
單分子反應理論的計算,為此需要知道A和A的結構和性質,E、E和分子內能在各振轉能級間的分配,以及一個振動自由度在A中轉變為沿反應坐標的平動能。
RRKM理論是比較成熟的單分子反應理論,已成功地套用於很多氣體分子的熱分解、異構化和雷射引起的多光子解離等反應。但是該理論著重於統計理論的套用,而實際上單分子反應不僅受隨機過程的支配,而且還應遵循動力學規律。近來已有不少關於非RRKM行為的單分子反應報導。
斯萊特理論與RRKM理論相反,N.B.斯萊特用經典力學方法,由動力學角度將單分子反應與分子振動的理論聯繫起來,其中不涉及統計理論。斯萊特理論仍採用林德曼碰撞激發的簡單模型,並假設進入反應的分子是一個具有不同振幅和相位的系綜。但分子內能是不能在各正則模之間迅速轉移的,只有當分子中某一特定的內坐標q 超過某臨界值qc,例如某個鍵長超過其臨界張量時,才能發生單分子反應。這裡的反應速率ka不像RRKM理論中簡單地被看作是總能量的函式,而是取決於能量在各正則模中的分配方式。但是,該理論的計算相當複雜,而且不少實驗已經證明分子內能重新分配是很快的,因而假設分子在碰撞前各正則模中的能量固定不變是欠妥的。雖然斯萊特理論後來曾作了某些修正,但它的套用範圍仍不如RRKM理論廣泛。
單分子反應的時滯理論
1922年,Lindemann(林德曼)等人提出了單分子反應的時滯理論,認為氣相單分子反應A→P,部分反應物分子A是經過分子間的碰撞獲得能量而達到活化狀態A*,獲得足夠能量的活化分子A*並不立即反應,而是經過一個分子內部能量的傳遞過程,以便把能量集中到要破裂的鍵上去。因此在碰撞之後與進行反應之間出現一段停滯時間。此時,活化分子可能進行反應,也可能消除活化而重新變成普通反應物分子。這一反應歷程(Lindemann歷程)可表示為:
A+M→A*+M
A*+M→A+M
A*→P
式中A*為富能活化分子,M可以是A分子,也可以是反應系統中其它非反應粒子。上述歷程中步驟並不是化學變化,而僅是分子間的傳能過程。
參考書目
P. J.Robinson and K. A. Holbrook, Unimolecular Reactions, John Wiley & Sons, New York,1972.