藥品名稱
【通用名稱】吡美莫司乳膏
【商品名稱】愛寧達® Elidel
【英文名稱】Pimecrolimus Cream
【漢語拼音】Bi Mei Mo Si Ru Gao
成份
 吡美莫司乳膏
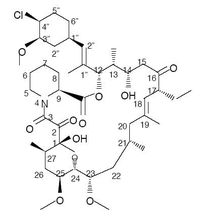
吡美莫司乳膏本品主要成份為吡美莫司,其化學名稱為(1R,9S,12S,13R, 14S,17R,18E,21S,23S,24R, 25S,27R)-12-[(1E)-2-[(1R,3R, 4S)-4-氯-3-甲氧基環己基] -1-甲基乙烯基]-17-乙基-1,14-二羥基-23,25-二甲氧基-13,19, 21,27-四甲基-11,28-二惡-4-氮雜三環[22.3.1.04.9]二十八碳-18-烯-2,3,10,16-四酮
分子式為C43H68NO11Cl
分子量為810.47
其結構式為:
每克1% 愛寧達® 乳膏含10mg 吡美莫司,賦形劑為白色,含苯甲醇、十六醇、檸檬酸、單甘油酯和甘油二酯、油醇、丙二醇、十八烷基硫酸鈉、氫氧化鈉、十八醇、甘油三酯和水。
所屬類別
化藥及生物製品>>皮膚科用藥>>其他皮膚科用藥
適應症
適用於無免疫受損的2 歲及2歲以上輕度至中度異位性皮炎(濕疹)患者。
●短期治療疾病的體徵和症狀。
●長期間歇治療,以預防病情加重。
不良反應
最常見的不良事件是局部用藥反應,研究報告顯示,吡美莫司乳膏治療組的發生率為19% 的患者,對照組為16%。不良反應通常發生於治療早期,一般為輕度或中度,持續時間短。
發生率估計:很常見(≥ 1 /10);常見(≥1/100,<1/10);不常見(≥1/1,000,< 1/100);少見(≥ 1/10,000,< 1/1,000);非常少見(<1/10,000,包括個案報告)
--很常見:用藥部位燒灼感。
--常見:用藥局部反應(刺激、搔癢和紅斑),皮膚感染(毛囊炎)。
--不常見:癤、膿皰瘡、單純皰疹、帶狀皰疹、單純皰疹樣皮炎(皰疹樣濕疹)、傳染性軟疣、皮膚乳頭狀瘤、用藥局部不適,如皮疹、疼痛、麻木、脫屑、乾燥、水腫和病情加重。
禁忌
對吡美莫司或其它聚內醯胺類藥物過敏或對任何一種賦形劑過敏者禁用。
臨床試驗
 吡美莫司乳膏
吡美莫司乳膏臨床數據
在包括嬰兒(≥3個月)、兒童、青少年和成人在內的2000 多名受試者進行的Ⅱ期和Ⅲ期臨床試驗中,對吡美莫司乳膏進行了有效性和安全性評價。其中,吡美莫司乳膏治療組1500 多例患者,對照組500 多例,用吡美莫司乳膏的賦形劑和/或外用皮質類固醇激素。
短期(急性)治療
兒童和青少年: 進行了兩個為期6周的賦形劑對照臨床試驗,受試兒科病人403名,年齡2-17歲。患者外用吡美莫司乳膏每日兩次。將兩項研究的數據匯總。
嬰兒:進行了一項類似的為期6 周的臨床試驗,參加病人數186 名,年齡3-23 個月。
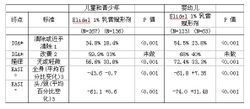
在這三項為期6 周的試驗中終點的有效性結果:
附表說明:
*:IGA 研究者總體評估
°:EASI 濕疹面積嚴重度指數: 臨床體徵(紅斑、浸潤、抓痕、苔蘚化)和受累皮膚面積的平均百分比變化
1:P 值(CMH檢驗)
2:改善=IGA 值比基線值低
3:P 值的計算基於第43 天(研究終點)時EASI 的ANCOVA 模型數據,並以EASI 基線值(第一天)為共變數,以研究中心和治療差異為影響因素。
在治療的第1 周, 44% 的兒童和青少年及70% 的嬰兒瘙癢症狀有明顯改善。
成人:
對患有中度至重度異位性皮炎的成年病人,吡美莫司乳膏短期治療(3周) 的療效不及0.1% 倍他米松-17-戊酸酯。
長期治療:
進行了兩項雙盲對照試驗,對713 名患有異位性皮炎的兒童和青少年(2-17 歲251 名嬰兒(3-23 個月)進行了長期療效的研究。吡美莫司乳膏作為基礎治療藥物。
為了預防病情加劇,患者一出現瘙癢和皮膚發紅的症狀,就應開始使用吡美莫司乳膏。只有病情太嚴重,用吡美莫司乳膏不能控制時,才開始局部使用中效皮質類固醇激素。一旦開始使用皮質類固醇治療,即停用吡美莫司乳膏。為保持雙盲,對照組採用吡美莫司乳膏賦形劑。
兩項研究均顯示,吡美莫司乳膏明顯降低病情加重的發生率(P [0.001);在所有的次要評估指標中(濕疹面積嚴重度指數(EASI) 、研究者總體評估(IGA) 、受試者評估), 吡美莫司乳膏都顯示了優越的臨床有效性。吡美莫司乳膏治療一周內即可控制瘙癢。較多的使用吡美莫司乳膏的病人完成了6 個月和12 個月的治療而沒有病情加劇,其中完成6 個月的治療的病人中,兒童:吡美莫司乳膏組為61%, 對照組為34%; 嬰兒: 吡美莫司乳膏組為70%, 對照組為33%; 完成12個月治療的病人中,兒童:吡美莫司乳膏組為51%,對照組為28%;嬰兒:吡美莫司乳膏組為57%,對照組為28%。
吡美莫司乳膏對局部用皮質類固醇有“節約效應”: 更多的使用吡美莫司乳膏治療的患者12 個月沒有再使用皮質類固醇激素(兒童:吡美莫司乳膏組57%,對照組32%;嬰兒:吡美莫司乳膏組64%,對照組35%)。吡美莫司乳膏的療效持久。
一個為期6個月的隨機、雙盲、平行、賦形劑對照試驗,以類似的試驗設計,對192名患有中度至重度異位性皮炎的成人患者進行了研究。24周的治療期中,局部用皮質類固醇的天數占吡美莫司乳膏治療組的總治療天數的14.2±24.2%,而在對照組,此比例為37.2 ± 34.6%(P[0.001)。吡美莫司乳膏治療組中50.0 %的病人沒有病情加劇,而對照組為24.0 %。
一項對患有中度至重度異位性皮炎的成人患者進行的為期一年的雙盲對照研究,對吡美莫司乳膏和0.1%曲安奈德乳膏加1%醋酸氫化可的松乳膏(用於面部、頸部和擦破的部位)的療效進行了比較。吡美莫司乳膏和外用皮質類固醇的使用均不受限制。對照組一半的病人接受局部用皮質類固醇激素治療的天數達研究天數的95 %以上。對患有中度至重度異位性皮炎的成人,吡美莫司乳膏的長期治療(52 周)的療效不及0.1 %曲安奈德乳膏(用於軀幹和四肢)加1%醋酸氫化可的松乳膏(用於面部、頸部和擦破的部位)。
長期臨床試驗為期一年。尚沒有一年以上的治療臨床資料。
尚無每日用藥多於兩次的研究。
特別研究:
耐受性研究顯示吡美莫司乳膏沒有接觸致敏性、光毒性或光敏性,也沒有顯示任何累積刺激性。
與中效和強效局部用類固醇(0.1%倍他米松-7-戊酸酯乳膏,0.1%曲安奈德乳膏) 和賦形劑相比,吡美莫司乳膏的致皮膚萎縮性在16 名接受治療的健康志願者中進行了測試,兩個局部用皮質類固醇經超聲檢查顯示、均明顯降低皮膚厚度,而與之相比,吡美莫司乳膏和賦形劑均不導致皮膚厚度下降。
上市後經驗:
大規模的產品上市後臨床觀察顯示本品並不增加惡性腫瘤發生的危險性。在臨床試驗中使用本品進行治療的患者的惡性腫瘤的發生率低於用賦形劑和/或外用皮質激素。而自發性報告的數據顯示,沒有證據顯示使用本品的患者和普通人群相比,惡性腫瘤的發生率會增加。截止到2005年5月,在超過580萬套用吡美莫司乳膏治療的患者中共收到28 例惡性腫瘤(14例為淋巴瘤、8例為皮膚惡性腫瘤,6例為其他不同種類的惡性腫瘤)病例報告。但是考慮外用本品極低的系統吸收和尚無本品干擾正常免疫系統的證據,惡性腫瘤的發生和本品的相關性尚不能確立。
藥理毒理
藥理作用:
吡美莫司是親脂性抗炎性的子囊黴素巨內醯胺的衍生物,可細胞選擇性地抑制前炎症細胞因子的產生和釋放。吡美莫司與macrophilin-12 有高親和性,能抑制鈣依賴性磷脂酶神經鈣蛋白。因此,能阻斷T 細胞內的炎症細胞因子的合成。
在皮膚炎症的動物模型中,局部或系統性用藥後,吡美莫司表現出強抗炎活性。在過敏性接觸性皮炎的豬模型中,外用吡美莫司與強效皮質類固醇激素作用相當。與皮質類固醇激素不同,吡美莫司不引起豬的皮膚萎縮,也不影響鼠皮膚的郎格罕斯細胞。
毒理研究:
遺傳毒性:
Ames 試驗、小鼠淋巴瘤L5178Y分析、中國倉鼠V79 細胞染色體畸變試驗和小鼠微核試驗均未見本品有致突變或致裂變的潛在危險。
生殖毒性:
大鼠生殖毒性試驗中,口服劑量達到490mg/m2/天時,觀察到輕微的母體毒性、發情周期紊亂、植入後流產和窩仔數減少現象。該劑量水平相應的外推平均AUC0-24h為1448ng•h/ml(相當於成人患者最大暴露量的至少63 倍)。在劑量水平達到110mg/m2/天, 對生殖能力沒有影響。該劑量水平相應的外推平均AUC0-24h為465ng•h/ml (相當於成人患者最大暴露量的至少20 倍)。兔口服生殖毒性試驗中, 在劑量水平達72mg/m2/天時,觀察到了母體毒性,但沒有胚胎毒性或致畸性。該劑量水平相應的外推平均AUC0-24h 為147ng•h/ml(相當於成人患者最大暴露量的至少6 倍)。
一項經皮給藥生殖毒性試驗中,大鼠及兔分別給予最大劑110mg/m2/天以用藥劑量36mg/ m2/天時,沒有觀察到對母鼠或胎鼠的毒性作用。對於兔而言,該劑量相應的平均AUC0-24h 為24.8ng•h/ml。對於大鼠,不能計算出AUC。
致癌性:
一項為期2年的大鼠經皮給藥致癌性試驗中,使用1% 吡美莫司乳膏劑量達到實際套用最高劑量110mg/m2/天時,沒有觀察到皮膚或全身性致癌作用。該劑量的平均AUC0-24h為125ng• h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的3.3倍)。在使用吡美莫司酒精溶液的小鼠皮膚致癌性試驗中,達到最大劑量12mg/m2/天時,沒有觀察到皮膚或其他器官腫瘤發生率增加。該劑量相應的平均AUC0-24h為1040ng•h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的27 倍)。
在使用1% 吡美莫司乳膏的裸鼠皮膚致癌性試驗中, 最大劑量達到30mg/ m2/天時,與賦形劑處理的動物相比,沒有觀察到光化致癌作用。該劑量相應的平均AUC0-24h為2100ng•h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的55 倍)。
在小鼠口服致癌性試驗中, 劑量達到135mg/ m2/天時,與對照組相比,淋巴瘤發生率增加了13%,被認為與免疫抑制作用有關。該劑量相應的平均AUC0-24h 為9821ng•h/ml (相當於臨床試驗中所觀察到兒童患者最大暴露量的258 倍)。劑量為45mg/m2/天, 相應的平均AUC0-24h為5059ng•h/ml 時(相當於臨床試驗中所觀察到兒童患者最大暴露量的133 倍),沒有發現對免疫系統的影響或淋巴瘤發生。
在大鼠口服致癌性試驗中, 劑量達到110mg/m2/天時,沒有觀察到致癌作用。該劑量超過了最大耐受劑量,其相應的平均AUC0-24h 為1550ng•h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的41倍)。
在為期39 周的猴口服毒性試驗中,以15mg/kg/天的劑量開始給藥時,觀察到了劑量相關的IRLD (免疫抑制相關的淋巴增生障礙)。IRLD 與淋巴隱病毒(LCV) 和其他機會性感染有關。該劑量水平相應的平均AUC0-24h為1193ng•h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的31 倍) 。在45mg/kg/天的劑量水平,相應的平均AUC0-24h 為3945ng•h/ml(相當於臨床試驗中所觀察到兒童患者最大暴露量的104 倍),出現了IRLD,且伴有死亡/瀕死、進食和體重減少、繼發於藥物相關免疫抑制作用病理改變。停止給藥後,可觀察到動物康復和/或至少部分病症逆轉。
孕婦及哺乳期婦女用藥
妊娠:對於吡美莫司乳膏用於妊娠婦女尚無足夠資料。皮膚用藥的動物實驗未顯示吡美莫司乳膏有與胚胎/胎兒發育相關的直接或間接的有害影響。口服給藥的動物研究顯示該藥有生殖毒性(見“臨床前安全性資料”)。由於外用吡美莫司乳膏後吡美莫司吸收很少,(見[藥代動力學]),因此對人體的潛在危害性比較小。但是妊娠期不應使用吡美莫司乳膏。哺乳:尚未進行關於外用藥對乳汁分泌的影響的動物實驗和吡美莫司乳膏在哺乳婦女的用藥研究。對於使用吡美莫司乳膏後吡美莫司是否會分泌到乳汁中尚不明確。
然而,由於局部使用吡美莫司乳膏後,吡美莫司吸收很少,(見【藥代動力學】),因此對人體的潛在危險性比較小。但吡美莫司乳膏仍應慎用於哺乳婦女。
哺乳婦女可套用吡美莫司乳膏,但不要用於乳房部位,以免新生兒無意中經口攝入。
貯藏
25℃以下保存,請勿冷凍。避免兒童誤取。
包裝
鋁管包裝,內層襯以保護性酚-環氧樹脂塗層,帶聚丙烯鏇蓋。
15 克/支/盒,30 克/支/盒。
有效期
24月。包裝首次開啟後:12月。

