反硫化作用是在厭氧條件下微生物將硫酸鹽還原為H2S的過程。其反應如下:
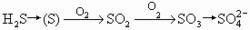 順向為硫化反應,逆向為反硫化反應。
順向為硫化反應,逆向為反硫化反應。RH2+SO42- -→RO4+H2S+能量該過程是在通氣不良條件下主要由硫酸鹽還原菌(或名反硫化菌)所引起。反硫化作用具有高度特異性,主要是由脫硫弧菌屬(Desulfovibrio)來完成,另外也有脫硫彎桿菌。這兩者均為厭氧型異養菌。在無氧條件下生活,利用硫酸鹽為電子受體,許多碳水化合物、有機酸和醇作為電子供體和能源,不利用氧(O2)和有機硫化物。可進行以下反應,將硫酸還原成硫化氫。2CH3CHOHCOOH+H2SO4→2CH3COOH+2CO2+H2S
C6H12O6+3H2SO4→6CO2+6H2O+3H2S+能量
如脫硫脫硫弧菌(D.desulfuricans)是一典型反硫化作用的代表菌,其反應式為:
C6H12O6+3H2SO4→6CO2+6H2O+3H2S+能量
產生的H2S與鐵化學氧化產生的Fe2+反應形成FeS和Fe(OH)2,這是造成鐵鏽蝕的主要原因。 另外,H2S的產生對作物生長不利。
煤制氫氣,一氧化碳變換工藝中的反硫化
工業上可以使用煤氣化製取合成氣,其主要組成為CO、H2、CO2等。而若需要製備供合成氨、油品加氫等工藝所用的純氫氣,則需要將CO變換為H2,CO轉化為CO2而通過吸收除去。變換反應為:CO+H2O=CO2+H2.此反應需要使用催化劑,包括耐硫和非耐硫催化劑。
耐硫變換催化劑現在工業上基本使用鈷鉬系催化劑,這個催化劑做得比較好,不僅耐硫,而且低溫活性也必鐵系催化劑(非耐硫催化劑)強,使用溫度在250-500度。
鈷鉬耐硫變換觸媒在活性組分處於硫化狀態下才具有活性,因此對合成氣中硫含量的上限不加限制,但對下限有嚴格的指標,要求使用的原料中含硫量不能小於某一數值,否則將出現反硫化現象而引起觸媒的失活。因此應避免已硫化觸媒在無硫情況下操作。
鈷鉬系觸媒的反硫化主要是觸媒中的活性組分CoS和MoS2在一定的溫度下,蒸汽和H2S存在條件下,發生了硫化反應的逆反應,重新轉化成了無活性的CoO、MoO2,主要是MoS2的反硫化。
MoS2+2H2O==MoO2+2H2S-Q
引起反硫化的因素主要有:汽氣比過大,硫化氫濃度過低,反應溫度過高等。
1、汽氣比過大
從反應方程式可以看出,水蒸汽含量高時,反應將向反硫化方向進行;
2、氣體中硫化氫含量低
/氣體中的硫化氫含量低時,反應將向著反硫化的方向進行;
3、反應溫度高
反硫化反應是吸熱反應,溫度高有利於反應向正方向進行,溫度高時,反應速度同時加快
反硫化產生的原因要看具體運行情況。進口硫化氫即使達到150mg,也不見得就不會發生反硫化,關鍵是要看操作,汽氣比不能過大,關鍵要監視變換爐進出口硫化氫、總硫含量變化,一旦出現倒掛現象要及時處理。

