原理簡介
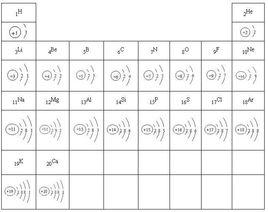
 原子結構示意圖
原子結構示意圖如圖是一些原子的原子結構示意圖。
1,核外電子是分層排列的,從裡到外1,2,3,4,5,6,7。
2,第一層最多2個電子,第二層最多8個電子,當電子層超過三層時,倒數第二層不超過18個電子;當電子層超過四層時,倒數第三層最多不超過32個電子,最外層不超過8個電子。
3,最外層8個電子的結構叫做穩定結構(特殊的是稀有氣體中的氦是最外層2個電子)。
4,金屬原子最外層電子數<4易失電子。
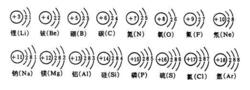 原子結構示意圖
原子結構示意圖5.每層最多排2×(n)^2個電子(n表示層數)
6.非金屬原子最外層電子數≥4 容易得到電子. 化學性質不穩定
7.稀有氣體最外層電子數是8個. He:(2個)不得不失(達到最穩定狀態,所以稀有氣體性質較穩定)。
詳細內容
內容
歸結起來大體有如下幾點:
知道1~20號(編號數即核內質子數)元素的名稱、符號和核電荷數(即質子數)。
理解圖中的符號和數字所表示的意義。
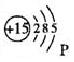 磷原子結構示意圖
磷原子結構示意圖現以磷原子結構示意圖為例,具體說明。“Ο”,表示原子核,圈內“+”號, 表示質子所帶電荷的性質;圈內數字“15”,表示核內15個質子;圈外弧線,表示電子層,弧線所夾的數字為該層容納的電子的數目。磷原子有3條弧線,表示它共有3個電子層。2,8,5表示第一、二、三電子層有2,8,5個電子。(K、L、M、N、O、P、Q由里到外)
不管是什麼原子,核電荷數=質子數=電子數,電量相等,電性相反,整個原子呈電中性(即不顯電性)。
原子結構示意圖不僅可以表示中性原子,還能表示帶電的原子—一離子(包括陽離子和陰離子)核外電子排布的情況。原子結構示意圖不能區別同一元素的多種 同位素(因其不能表示中子數)
共價化合物
什麼是共價化合物?共價化合物是怎樣形成的?共價化合物是依靠共用電子對形成分子的化合物。
當兩種非金屬元素的原子形成分子時,由於兩個原子都有通過得電子形成8電子穩定結構的趨勢,它們得電子的能力差不多,誰也不能把對方的電子奪過來,這樣兩個原子只能各提供一個電子形成共用電子對,在兩個原子的核外空間運動,電子帶負電,原子核帶正電。兩個原子的原子核同時吸引共用電子對,產生作用力,從而形成了一個分子分子是由原子構成的。
①極性鍵 :由於兩個原子對電子的吸引能力不一樣,共用電子對總是偏向得電子能力強的一方,這一方的原子略顯負電性,另一方的原子略顯正電性,作為整體,分子仍顯電中性。
比較典型的共價化合物是水、氯化氫以及二氧化碳。共用電子對總是偏向氧原子的一方,偏離氫原子的一方。
②非極性鍵:某些單質的分子也是依靠共用電子對形成的。例如氯氣的分子就是由兩個氯原子各提供一個電子形成共用電子對,電子對同時受兩個原子核的作用形成氯分子。由於同種原子吸引電子能力相仿,電子對不偏向任何一方。
(4)共價化合物的物理性質
共價化合物一般硬度小,熔沸點低。
英文:Schematic diagram of atomic structure
規律
各電子層最多容納的電子數目是2n2。 其次,最外層電子數目不超過8個(K層為最外層時不超過2個)。 第三,次外層電子數目不超過18個,倒數第三層電子數目不超過32個。 核外電子總是儘先排布在能量最低的電子層里,然後再由里往外依次排布在能量逐步升高的電子層里。