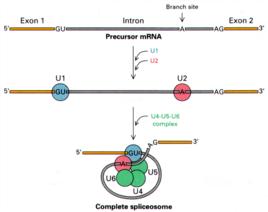
簡介
它是在剪接過程的各個階段隨著snRNA的加入而形成的。也就是說在完整的pre-mRNA 上形成的一個剪接中間體。剪接體本身需要一些小核RNA參與。這些小核RNA不會翻譯出任何蛋白,但對於調控遺傳活動起到重要作用。
與核糖體
剪接體的裝配同核糖體的裝配相似。依靠RNA-RNA、RNA-蛋白質、蛋白質-蛋白質等三方面的相互作用。可能比核糖體更複雜,要涉及snRNA的鹼基配對, 相互識別等。
由多個核蛋白聚集而成,具有識別mRNA前體的5'剪接位點、3'剪接位點和分支點的功能。
研究進展
完善分子生物學中心法則
為何這兩篇文章如此重要?
在分子生物學上,“中心法則”是描述細胞最基礎也最核心的生命活動基因表達的一套規律,於1957年由英國生物學家克里克提出,對中心法則各個環節中重要生物大分子的組成、結構和功能的研究從來都是生命科學家們追逐的前沿熱點。中心法則的發現與闡述伴隨著多個諾貝爾獎的產生。而20多年過去了,其中公認最艱難的部分就是RNA剪接的清晰結構和複雜機理。
在所有真核細胞中,基因表達分三步進行,分別由 RNA 聚合酶(RNA polymerase) 、剪接體(Spliceosome) 、和核糖體(Ribosome)執行。首先,儲存在遺傳物質DNA序列中的遺傳信息必須通過RNA聚合酶的作用轉變成前體信使RNA (precursor messenger RNA, 簡稱pre-mRNA),這一步簡稱 轉錄(transcription);其次,前體信使RNA由多個內含子和外顯子間隔形成,必須通過剪接體的作用去除內含子、連線外顯子之後才能轉變為成熟的信使RNA,這一步簡稱 剪接(splicing);第三,成熟的信使RNA必須通過核糖體的作用轉變成蛋白質之後才能行使生命活動的各種功能。描述這一過程的規律被稱為生物學的中心法則,其在生命科學領域具有核心重要性。
其中,RNA聚合酶和核糖體的結構解析曾分別獲得2006年和2009年的諾貝爾化學獎。而 剪接體是一個巨大而又複雜的動態分子機器,其結構解析的難度被普遍認為高於 RNA 聚合酶和核糖體,是世界結構生物學公認的兩大難題之一。
施一公告訴《賽先生》:“我們的工作揭示了基因剪接的結構基礎,可以把大部分生化數據連在一起,能夠很好地解釋過去的數據,也可以預測將來的實驗結果,但未來還要繼續推進這一項基礎研究工作,得到一系列的結構之後才能把中心法則的基因剪接全過程描述清楚。”
從施一公研究組發表的這兩篇論文可以看出,他們解析的基因剪接體是好幾個主要剪接體的共有結構。施一公表示,下一步的工作重點是把不同剪接體相互間不同的地方看清楚,從而闡述內含子被去除,外顯子被接在一起的分子機制。
一直以來,對剪接體的結構解析是分子生物學裡最熱門的研究之一。其中最有力的競爭者是劍橋大學分子生物學實驗室的日裔學者Kiyoshi Nagai博士,此前該領域近一半的工作都與他有關。而他所在的實驗室也是現代結構生物學和分子生物學的奠基之處,這裡曾走出14名諾貝爾獎得主。
6月24日,Nagai研究組的一篇論文於《自然》網站線上發表,其工作將剪接體所涉及的一個中心複合物tri-snRNP的解析度提高到了5.9個埃米,一度引起轟動。而此前人類對基因剪接體的認識精度只有29個埃米。1埃米為10^(-10)m,即把1米分成十億份,其之微小可以想見,因此Nagai的最新工作被稱為近原子尺度的結構研究。
而施一公團隊此次得到的結果不僅將精度由5.9個埃米提高到了3.6個埃米,而且其解析對象是真正的剪接體,而不是Nagai團隊所取得的參與剪接體組裝過程的複合物,從而第一次在近原子解析度上看到了剪接體的細節。
長久以來,剪接體的結構解析一直被認為是最值得期待的結構生物學研究。因為許多人類疾病都可以歸咎於基因的錯誤剪接或針對剪接體的調控錯誤。據知人類35%的遺傳紊亂是由於基因突變導致單個基因的可變剪接引起的。還有一些疾病的起因是剪接體蛋白的突變影響了許多轉錄本的剪接。還有一些癌症也與剪接因子的錯誤調控有關。
但儘管如此,施一公強調說:“這是一個基礎研究層面的發現,和套用差距甚遠。現在我們還不想談套用,這會誤導大家。”
在施一公看來,這次獲得的剪接體的高分辨三維結構和分子作用機制是一項生命科學基礎研究的重大突破,但基礎研究工作還未完成,需要進一步細化。 即便基礎研究做完了,也與治療遺傳疾病的實際套用有很大距離。“因為不能說根據我們的剪接體結構就能直接發現引致疾病發生和治療的方法。這項工作的核心意義是讓人類對生命過程和機理有了更進一步的了解。”施一公說。
注意問題
但是,他們沒有看到的也許比看到的更重要。儘管研究人員在試管中檢測剪接時看到了剪接體機器裝配自己的複雜過程,但是研究組研究生活細胞中的剪接體時發現剪接發生在機器形成之前。這與先前已經知道的細胞最佳化它們的工作量的方式相一致。