分子的離解能
正文
一個處於最低能態的分子分解為完全獨立的原子時,從外界吸取的最小能量。分子有振動零點能(見雙原子分子振動-轉動光譜),同位素效應使折合質量小的分子零點能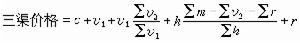 較高,但由分子內部電荷結構決定的電勢能W仍一樣;雙原子分子的離解能為
較高,但由分子內部電荷結構決定的電勢能W仍一樣;雙原子分子的離解能為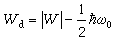 ,因此折合質量小的同位素分子的離解能較小。例如H2、HD和D2分子(其中D為氘原子,是氫的同位素)中,H2的離解能最小,為4.478 00eV,HD和D2分子的離解能分別為4.513 69eV和4.556 18eV。
,因此折合質量小的同位素分子的離解能較小。例如H2、HD和D2分子(其中D為氘原子,是氫的同位素)中,H2的離解能最小,為4.478 00eV,HD和D2分子的離解能分別為4.513 69eV和4.556 18eV。 對於以離子鍵結合的分子,還可能分解為完全獨立的離子,這種離解能與上面定義的離解能有區別。例如氯化鈉分子(NaCl)離解為完全獨立的原子至少需要3.58eV,而離解為完全獨立的Na+和Cl-離子至少需要5.00eV。
化學領域中所說的分子離解能是指在 1個大氣壓和25°C溫度下 1摩爾理想氣態分子分解成完全獨立的原子所需的最小能量。例如 1摩爾氫分子在上述條件下分解為完全獨立氫原子,至少需要從外界吸取4.362×105 J熱量。對雙原子分子,離解能也是鍵能。對多原子分子,離解能和鍵能的概念不同。例如NH3分子有三個等價的N─H鍵,但各鍵按分解先後次序其能量也不同,分別為4.310、3.849、3.598×105 J/mol,離解能應是三者之和,就是1.1757×106J/mol,而平均鍵能是三者之平均值,3.919×105J/mol。
用光譜方法測量分子振動帶限的頻率來確定雙原子分子的離解能,比用化學方法測得的值準確得多。
