克萊森重排的發現背景
克萊森重排(Claisen rearrangement)烯醇或酚的烯丙基 醚加熱到200℃以仁時發生分子內重排,烯丙基從氧原子遷 移到碳原子上,稱為克萊森重排。克萊森重排起初是在芳香化合物中發現的,這與當時(20世紀初期)合成化學家主要注意力集中的範圍局限在芳香烴上有關。後來發現該反應可以拓展到非芳香化合物上,這種拓展非常重要,因為克萊森重排反應立刻變成了一種非常有用的反應。
在醚類化合物中,如果存在烯丙氧基與碳碳雙鍵相連的結構,就有可能發生克萊森重排。
現代有機合成在克萊森反應的啟發下催生出了眾多的“變體”:包括貝勒斯(Bellus)變體、埃申莫瑟(Eschenmoser)變體、艾蘭德(Ireland)變體和強生(Johnson)變體等。
克萊森重排的經典形式
 克萊森重排
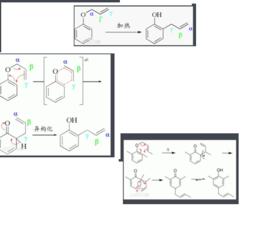
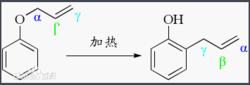
克萊森重排克萊森重排反應最經典的形式是烯丙基苯基醚在高溫(> 200°C)下重排,得到鄰烯丙基苯酚。反應的機理是σ[3,3]重排(這也是最早發現的σ[3,3]重排反應),中間產物4-烯酮不穩定(無芳香性),會互變異構為有芳香性的酚。
克萊森重排的反應機理
這個反應的特點是高度的區域選擇性,產物大部分是鄰位的。這一點與弗里斯重排(酚酯的醯基到鄰對位)很相似(右圖)。
 克萊森重排
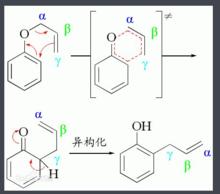
克萊森重排值得注意的是若苯環的兩個鄰位被堵住,則重排到對位。此時,反應產物是對位烯丙基取代物。這是因為中間產物發生了一個重排反應所致(右圖)。
 克萊森重排
克萊森重排審視整個過程可以看到:克萊森重排反應的驅動力是生成熱力學穩定的取代度最大的“烯烴”。
交叉反應表明:克萊森重排是嚴格的分子內反應。用碳14標記的烯丙基醚(標記γ碳)為反應原料,重排後碳14原子與苯環相連,雙鍵位置發生轉移。兩個鄰位上都有取代基的烯丙基酚,發生兩次重排後,則恢復了原來位置,則仍是α碳原子與苯環相連。
克萊森重排的特殊情況
克萊森重排對其他反應也是通用的。例如:非芳香性的烯丙基乙烯基醚的重排,因為沒有烯醇化的驅動力,而停留在羰基階段,被稱為脂肪族的克萊森重排。
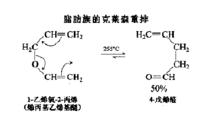 克萊森重排
克萊森重排克萊森重排中氧變成碳以後的類似反應,成為柯普重排。它發生在含有1,5-二烯單元的化合物中。
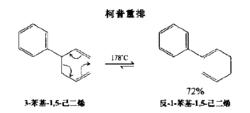 克萊森重排
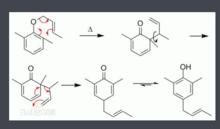
克萊森重排異常克萊森重排是正常的克萊森重排的產物進一步重排,使β-碳原子與環相連的反應。最早發現於1971年。正常克萊森重排是直接得到醇或者酚,而異常克萊森重排是先得到酮,再發生氫轉移,同時伴隨烯丙基的重排,最終生成酚。機理是首先發生正常的克萊森重排,然後經過三元環中間體,得到產物。
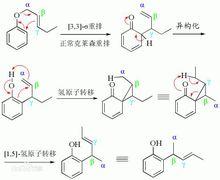 克萊森重排
克萊森重排克萊森重排的影響因素
一般地說,周環反應不受試劑和溶劑的極性的影響,也不受催化劑和引發劑的影響。然而,仔細研究仍可發現諸多因素能影響本反應。其中主要是溶劑效應,同位素效應和結構因素。
溶劑效應
溶劑對本反應速率的影響很大。在十七種不同溶劑中,反應速度能差約300倍。常用的溶劑有二苯醚,聯苯,四氫蔡及三氟醋酸等。其中以三氟醋酸最優。這主要是由於芳香族化合物的溶劑化效應的存在。極性溶劑要比在非汲性溶劑反應快。如間二甲酚的烯丙基醚.強極性溶劑利於重排到鄰位,弱極性溶劑有利生成對位異構體。
同位素效應
同位素效應的存在也會影響產物的比率。對於上例中的化合物,隨著苯環上的H被D取代,對位異構體的比例會相應增加。
結構因素
結構因素對脂肪族的lCiasen重排的影響可以忽略,但對芳香族化合物來說,取代基對反應的影響較明顯。通常芳環上的斥電子基可使反應速率加快;吸電予則減慢。一般這種影響相差約20~30倍。這大概是它們使芳環活化或鈍化造成的。lCalsen重排通常在無催化劑存在下進行的。但有些添加汞鹽,銀鹽或其他Lewis酸或鹼,可以大大加快反應速率。
總之,不同類型的lCiasen重排反應受化學環境的影啊是明顯存在的。目前這方面的研究工作不多,需要繼續更多更深入的探索。
克萊森重排的套用
自然界中,在植物代謝的莽草酸途徑中從分支酸到預苯酸的轉換步驟就是一個克萊森重排反應;該反應受分支酸歧化酶的催化。預苯酸是一個重要的前體化合物,生物體內含苯環的天然化合物有一大半是由預苯酸轉換過來的。克萊森重排的發現啟示著化學家們發現更多更複雜反應的化學本質。