酸和鹼的克當量
酸和鹼克當量的概念
強酸強鹼中和反應的實質是:
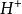 克當量
克當量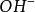 克當量
克當量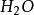 克當量
克當量+ ⇌
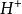 克當量
克當量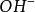 克當量
克當量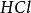 克當量
克當量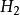 克當量
克當量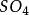 克當量
克當量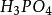 克當量
克當量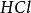 克當量
克當量 克當量
克當量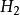 克當量
克當量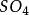 克當量
克當量 克當量
克當量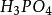 克當量
克當量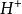 克當量
克當量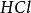 克當量
克當量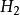 克當量
克當量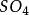 克當量
克當量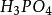 克當量
克當量因此 1摩爾的 離子需 1摩爾的 離子來中和。但不同的酸鹼發生中和反應時它們的質量關係又是什麼呢?為 了研究方便,先討論中和 1摩爾 ( 40克) NaOH所需幾種酸的摩爾數及其所提供離子的摩爾數和質量關係。由下表數據可知,儘管中和 1摩爾(40克)NaOH所需 , 和 摩爾數不同,但1摩爾 , 摩爾 , 摩爾 所提供離子的摩爾數是相同的。不同的酸摩爾質量不同,提供 1摩爾離子所需酸的質量也不同。我們把在化學反應中提供 1摩爾 離子所需酸的質量叫做該酸的克當量。例如 , 和 的克當量分別為36.5克,49克和32.7克。
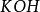 克當量
克當量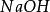 克當量
克當量 克當量
克當量同理,在化學反應中提供1摩爾離子所需的鹼的質量叫做該鹼的克當量。如 , , 的克當量分別為 56.1克, 40克, 37克。
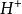 克當量
克當量分析表中酸的摩爾質量, 1摩爾酸提供 離子的摩爾數及酸的克當量,三者的 關係為
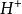 克當量
克當量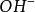 克當量
克當量酸(鹼)的克當量=酸(鹼)的摩爾質量 / 1摩爾酸(鹼)提供的 ( )摩爾數
 化學方程式表
化學方程式表酸鹼克當量的本質 —克當量的廣義概念
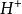 克當量
克當量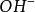 克當量
克當量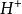 克當量
克當量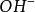 克當量
克當量我們已經知道,提供 1摩爾 離子所需酸的質量叫做酸的克當量。提供 1摩爾 離子所需鹼的質量叫做鹼的克當 量:而 1摩爾 離子和 1摩爾 離子 都帶 1摩爾單位電荷。所以,我們可以說在 反應中能提供 1摩爾單位電荷所需酸(鹼)的質量叫做酸(鹼)的克當量。
中和反應是一種複分解反應,離子都帶有電荷,可見酸鹼克當量的概念,可推廣到複分解反應中去,即在複分解反應中,每交換摩爾單位電荷所需物質的質量就是該物質的克當量。
在氧化——還原反應中,氧化劑和還原劑發生了電子的傳遞,如:
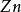 克當量
克當量 克當量
克當量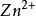 克當量
克當量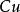 克當量
克當量+ = +
(還原劑)(氧化劑)
所以,對氧化劑和還原劑來說,每傳遞 1摩爾的電子所需氧化劑或還原劑命的質量就是它的克當量。
綜上所述,克當量的廣義概念應為交換或傳遞1摩爾單位電荷所需某物質的質量。
即克當量=物質的摩爾質量 / 1摩爾物質交換或傳遞電荷的摩爾數
這個關係式,既適用於求複分解反應 中各物質的克當量,又適用於求氧化還原反應中各物質的克當量。並且便於根據物質參加反應時的具體情況計算各物質的克當量。
計算克當量時應注意的幾個問題
當量定律指出:兩種物質總是以等克當量數進行化學反應的。實際上,不僅反應物與反 應物之間.而且反應物與生成物之間,生成物與生成物之間也都是等克當量數的。這一規律 經常被用在化學計算中,以使計算來得簡捷、準確。但是,在具體套用時,首先遇到的向題 是計算各物質的克當量。計算化合物的克當量時,大家都習慣於套用公式:化合物的克當量 =化合物的摩爾質量/化合物的正(負)價總數。而很多人在利用這個公式時,忽視了兩個 重要向題:一個是同一物質在不同的化學反應中可能表現出不同的克當量;另一個是這一計 算公式僅適合於化合物參加的基元反應。現舉例如下:
複分解反應中生成水的克當量
試看下面兩個反應:
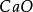 克當量
克當量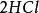 克當量
克當量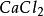 克當量
克當量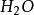 克當量
克當量+ = + ……(1 )
 克當量
克當量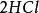 克當量
克當量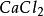 克當量
克當量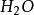 克當量
克當量+ = + ……(2 )
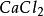 克當量
克當量按照上述計算化合物的克當量的公式,水的克當量應是:18/2= 9克/克當量。這樣. 在(1 )中生成1摩爾水相當於18克/9克/克當量=2克當量,從反應式中看出2克當量 CaO與2克當量HCI反應生成了 2克當量 和 2克當量水,這是符合當量定律的。
 克當量
克當量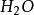 克當量
克當量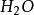 克當量
克當量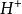 克當量
克當量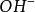 克當量
克當量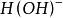 克當量
克當量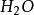 克當量
克當量但在反應(2)中,如果亦按上述公式來計算生成水的克當量,就會得出2克當量的 與2克當量HCl生成4克當量 的結果,這顯然違反了當量定律,當然是不 可能的。實際上,在反應(2 )中 是由一個 和一個 結合而成的,應把它按一價 化合物 對待,即在 分子中,正價總數和負價總數都是一,這樣水的克當量 就應該是18克/克當量,生成水的克當量數就不是4而是2 了。
在生成酸式鹽的反應中酸的克當量
請看下面這個反應:
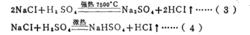 反應方程式
反應方程式可以看出,在反應(3)中,1摩爾HSO相當於2克當量HSO,而在反應(4)屮,1摩爾HSO相當於1克當量HSO,這是因為在未加熱的條件下,.生成HCI的溶解度很 大,在水中電離出的H+濃度很髙,足以抑制HSO的二級電離,使其只停留在一級電離階 段。故在反應(4)中硫酸的克當量不再是49克/克當量,而是98克/克當量。這樣,反應 (4 )仍然是符合當量定律的。
同理,當鹼與其它物質反應生成鹼式鹽的時候,鹼的克當量也是這樣計算的。
多歩反應中化合物的克當量
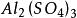 克當量
克當量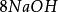 克當量
克當量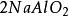 克當量
克當量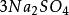 克當量
克當量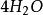 克當量
克當量+ = + +
如果用計算化合物的克當量的公式直接用於這一反應,就會得出6克當量Al( S0)與8 克當量NaOH完全反應的結論。這當然是違背當量定律的,這是因為這一反應方程式所表示 的是一個總反應式,而總反應式只能表明反應的始態物質與終態物質之間的計量關係,而不能反映出反應所經歷的真實過程。若按反應機理把上述反應分解成連續的基元反應,則各個 基元反應都是符合當量定律的。
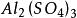 克當量
克當量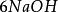 克當量
克當量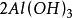 克當量
克當量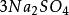 克當量
克當量+ = ↓ + (i)
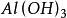 克當量
克當量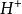 克當量
克當量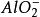 克當量
克當量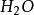 克當量
克當量= + + (ii)
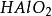 克當量
克當量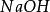 克當量
克當量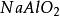 克當量
克當量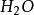 克當量
克當量+ = + (iii)
第(ii )步反應是Al(OH)兩性性質所決定的。由於在鹼性環境中,Al(OH)電 離、脫水、由三元鹼轉化為一元酸,所以它的克當量也隨著改變。
氧化還原反應物質的克當量
氧化還原反應昀特點是反應機理複雜,付反應多,反應速度慢,.而且隨著反應條件(溫度、濃度、催化劑、介質的性質、反應物填加次序等)的改變, 反應方式和產物也隨著改變,所以在氧化還原反應中.某一氧化劑(或還原劑)的氧化還原當量是經常改變著的,所以更應特別注意。
物質氧化還原當量E的計算公式是:
E=物質的摩爾質量/n
式中n是該物質在反應中得失電子數或氧化數的改變值。
在氧化還原反應中,氧化劑和還原劑在基元反應中也是符合當量定律的,例如反應
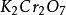 克當量
克當量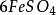 克當量
克當量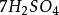 克當量
克當量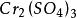 克當量
克當量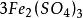 克當量
克當量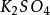 克當量
克當量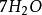 克當量
克當量+ + = + + +
其中氧化劑KCrO在反應中得到6個電子n=6,因此E= 294.18/6=49.03
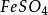 克當量
克當量還原劑FeSO在反應中失去一個電子,所以E =151.85/1=151.85
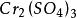 克當量
克當量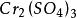 克當量
克當量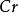 克當量
克當量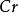 克當量
克當量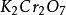 克當量
克當量生成物 的氧化還原當量應當這樣來考慮:因為一分子 有二個 原子,而這二個 原子是從 中的二個Cr原子得到6個電子轉變而來的。所以n= 6
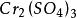 克當量
克當量E =391.90/6=65.31
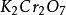 克當量
克當量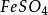 克當量
克當量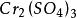 克當量
克當量反應方程中其它物質(介質及其產物除外)的氧化還原當量也是同樣算法,不再詳述.。可以看出在這一方程式中 、 、 的克當量數都是6,符合當 定律。
再舉下面兩個反應:
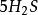 克當量
克當量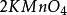 克當量
克當量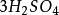 克當量
克當量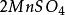 克當量
克當量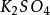 克當量
克當量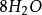 克當量
克當量+ + = + 5S↓ ++ (1)
10克當量 10克當量 10克當量 10克當量
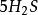 克當量
克當量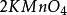 克當量
克當量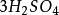 克當量
克當量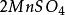 克當量
克當量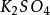 克當量
克當量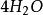 克當量
克當量+ + = + S↓ ++ (2)
10克當量 10克當量 10克當量 2克當量 8克當量
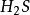 克當量
克當量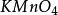 克當量
克當量這兩個反應的反應物和生成物都相同,只是所配係數不同。可以看出,在反應(1 ) 中,,,S的當量都數是10,.這是符合當量定律的。

