偏摩爾量
定義
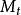 偏摩爾性質
偏摩爾性質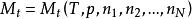 偏摩爾性質
偏摩爾性質對於一個均相系統的任一容量性質 可表示為 ,當T,p一定時,有:
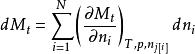 偏摩爾性質
偏摩爾性質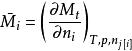 偏摩爾性質
偏摩爾性質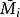 偏摩爾性質
偏摩爾性質令 ,稱 為偏摩爾量。
物理意義
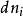 偏摩爾性質
偏摩爾性質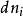 偏摩爾性質
偏摩爾性質偏摩爾量的物理意義為:當T,p一定時,在除組分i以外的其它組分都不變的條件下,加入微量的組分i時所引起系統容量性質的增量。也可以理解為:在有限的系統中,加入 摩爾的組分i,引起系統中任一容量性質的變化與 的比值。
系統總性質與各組分偏摩爾量之間的關係
根據偏摩爾量的定義,可得多元系容量性質的加和性:
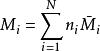 偏摩爾性質
偏摩爾性質上式表達了系統總性質與各組分偏摩爾性質之間的關係。
系統的摩爾性質
根據偏摩爾量的定義,可得多元系容量性質的加和性:
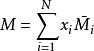 偏摩爾性質
偏摩爾性質上式表達了系統的摩爾性質為各組分的偏摩爾性質關於其摩爾分數的加權平均值。
注意事項
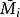 偏摩爾性質
偏摩爾性質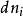 偏摩爾性質
偏摩爾性質(1)是研究多元系容量性質時重要的熱力學量,只有在同一個相內才有偏摩爾量的概念,且只有容量性質的狀態函式在T,p一定的條件下,對某組分的偏微分才是偏摩爾量。
 偏摩爾性質
偏摩爾性質(2)根據偏摩爾性質的定義,在處理相平衡和化學平衡問題時,通常指的是在恆溫、恆壓的條件下,化學位往往僅理解為偏摩爾自由焓。
摩爾性質與偏摩爾性質關係式
 偏摩爾性質
偏摩爾性質 偏摩爾性質
偏摩爾性質(1)摩爾性質關係式: ,對應偏摩爾性質關係式: ;
 偏摩爾性質
偏摩爾性質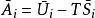 偏摩爾性質
偏摩爾性質(2)摩爾性質關係式: ,對應偏摩爾性質關係式: ;
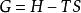 偏摩爾性質
偏摩爾性質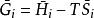 偏摩爾性質
偏摩爾性質(3)摩爾性質關係式: ,對應偏摩爾性質關係式: ;
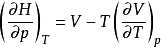 偏摩爾性質
偏摩爾性質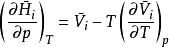 偏摩爾性質
偏摩爾性質(4)摩爾性質關係式: ,對應偏摩爾性質關係式: ;
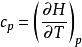 偏摩爾性質
偏摩爾性質 偏摩爾性質
偏摩爾性質(5)摩爾性質關係式: ,對應偏摩爾性質關係式:。
重要結論
內容
每一個關聯溶液各摩爾熱力學性質的方程式都對應一個關聯溶液中某一部分組成i的相應偏摩爾性質的方程式。
證明過程
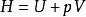 偏摩爾性質
偏摩爾性質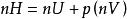 偏摩爾性質
偏摩爾性質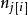 偏摩爾性質
偏摩爾性質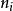 偏摩爾性質
偏摩爾性質(1)以摩爾焓為例,根據焓的定義式 ,則對於含n摩爾的溶液,有 。在T,p和 一定時,對 微分,得到:
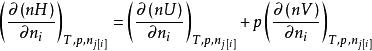 偏摩爾性質
偏摩爾性質按偏摩爾量的定義,上式可寫為:
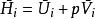 偏摩爾性質
偏摩爾性質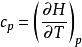 偏摩爾性質
偏摩爾性質(2)以摩爾熱容為例, ,該式在恆壓、組成不變的情況下成立,則對於n摩爾的混合物,有
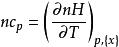 偏摩爾性質
偏摩爾性質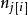 偏摩爾性質
偏摩爾性質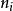 偏摩爾性質
偏摩爾性質在T,p和 一定時,對 微分,得到:
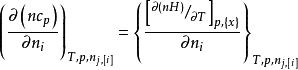 偏摩爾性質
偏摩爾性質或表達為:
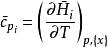 偏摩爾性質
偏摩爾性質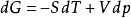 偏摩爾性質
偏摩爾性質(3)對於定組成溶液的熱力學基本方程式,有 ,則對於n摩爾混合物有:
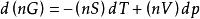 偏摩爾性質
偏摩爾性質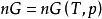 偏摩爾性質
偏摩爾性質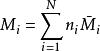 偏摩爾性質
偏摩爾性質由於n為常數,有 ,根據式 ,得
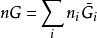 偏摩爾性質
偏摩爾性質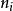 偏摩爾性質
偏摩爾性質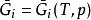 偏摩爾性質
偏摩爾性質當 不變時, ,因此
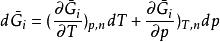 偏摩爾性質
偏摩爾性質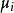 偏摩爾性質
偏摩爾性質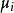 偏摩爾性質
偏摩爾性質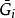 偏摩爾性質
偏摩爾性質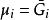 偏摩爾性質
偏摩爾性質由 的表達式可知, 與 是一致的,於是有 。
根據熱力學基本方程式可知,對於給定組成混合物,必存在關係:
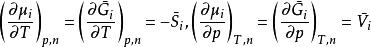 偏摩爾性質
偏摩爾性質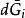 偏摩爾性質
偏摩爾性質將上述式子代入 方程式中,得到:
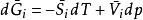 偏摩爾性質
偏摩爾性質上述三個例子說明一個事實:每一個關聯定組成溶液各摩爾性質的方程式,均存在一個與之對應的相似方程式,即關聯溶液中某組分相應的偏摩爾性質的方程式。
典例
例1
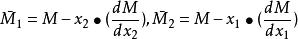 偏摩爾性質
偏摩爾性質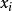 偏摩爾性質
偏摩爾性質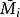 偏摩爾性質
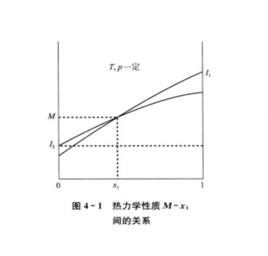
偏摩爾性質運用式 的關係來說明如何由M對 (恆定T,p下)的曲線圖來求取二元系統的 。
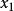 偏摩爾性質
偏摩爾性質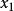 偏摩爾性質
偏摩爾性質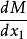 偏摩爾性質
偏摩爾性質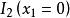 偏摩爾性質
偏摩爾性質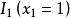 偏摩爾性質
偏摩爾性質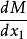 偏摩爾性質
偏摩爾性質解:典型的M對 的曲線圖是由任一組成 的 對曲線做切線求得的,該切線與M軸相交於 和 ,從而可以寫出兩個關於 的表達式
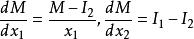 偏摩爾性質
偏摩爾性質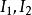 偏摩爾性質
偏摩爾性質由此得到 ,有:
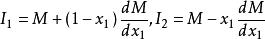 偏摩爾性質
偏摩爾性質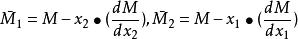 偏摩爾性質
偏摩爾性質將以上兩個方程式與條件中 比較,可得:
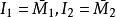 偏摩爾性質
偏摩爾性質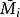 偏摩爾性質
偏摩爾性質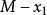 偏摩爾性質
偏摩爾性質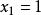 偏摩爾性質
偏摩爾性質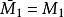 偏摩爾性質
偏摩爾性質 偏摩爾性質
偏摩爾性質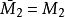 偏摩爾性質
偏摩爾性質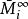 偏摩爾性質
偏摩爾性質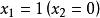 偏摩爾性質
偏摩爾性質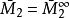 偏摩爾性質
偏摩爾性質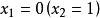 偏摩爾性質
偏摩爾性質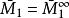 偏摩爾性質
偏摩爾性質所以,對於二元溶液的兩個組分的 值,等於在相應的組成處對 曲線所作的切線在M軸上的截距。當 時,由所作的切線可得 ;當 時,由所作的切線可得 。這兩條切線的另一端與相對應的M軸相交,據此可得出該組分在無限稀釋時的偏摩爾性質 ,因此在 時, ,而在 時, 。
例2
某二元系溶液混合物在固定T、p下的焓可用下式表示:
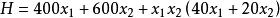 偏摩爾性質
偏摩爾性質 偏摩爾性質
偏摩爾性質式中H單位為 ,試確定在該溫度、壓力狀態下:
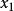 偏摩爾性質
偏摩爾性質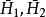 偏摩爾性質
偏摩爾性質(1)用 表示的 ;
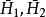 偏摩爾性質
偏摩爾性質(2)純組分焓 的數值;
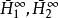 偏摩爾性質
偏摩爾性質(3)無限稀釋下液體的偏摩爾焓 的數值。
解:將混合物焓值表達式恆等變形可得
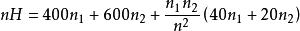 偏摩爾性質
偏摩爾性質(1)
根據公式可得:
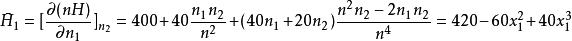 偏摩爾性質
偏摩爾性質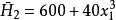 偏摩爾性質
偏摩爾性質(2)
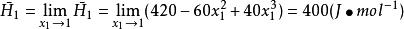 偏摩爾性質
偏摩爾性質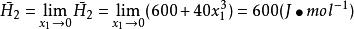 偏摩爾性質
偏摩爾性質(3)
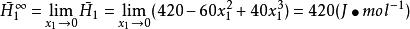 偏摩爾性質
偏摩爾性質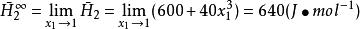 偏摩爾性質
偏摩爾性質