簡介
二苯乙醇酸重排(benzilic acid rearrangement),二苯基乙二酮在氫氧化鈉水溶液中重排為二苯乙醇酸的反應。
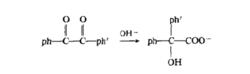 重排反應
重排反應此重排是不可逆的親核重排反應。
反應歷程如下:
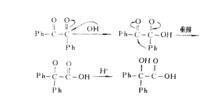 反應歷程
反應歷程上面的歷程說明,如用醇鈉作催化劑即得到相應的酯。脂肪族的α-二酮也能發生此類反應。
反應機理
α-二酮(R—CO—CO—R)用強鹼處理,可以發生重排生成α-羥基酸(RC(OH)—COOH)。偶苯醯(benzil,二苯基乙二酮)重排後,得到的是二苯乙醇酸(benzilic acid)。因此這種重排就統稱為二苯乙醇酸重排(benzilic rearrangement)。其反應機理可表示如下:
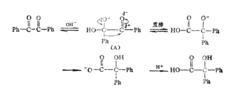 反應機理
反應機理機理的第一步是OH 加到一個羰基碳上,形成中間體(A)。被加成的碳上的Ph受臨近帶負電電荷的氧的影響,親核性增強了,於是帶著原來的成鍵電子對,向相鄰的帶有部分正電荷的另一羰基碳上遷移。然後,經過質子轉移,生成α-羥基酸負離子。再經酸化,即得α-烴基酸。質子轉移的一步是不可逆的。所以整個重排不能逆向進行。
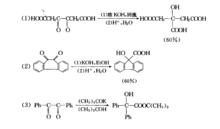
這個重排在有機合成上用為α-羥基酸的製法之一。偶苯醯在乙醇中用KOH催化,於100℃溫度下可順利重排。產物二苯乙醇酸是藥物安胃寧的中間體。
因為偶芳醯可由偶姻氧化生成,而芳偶姻可由相應芳醛經苯偶姻縮合製得,故有時將苯偶姻縮合產物(α-烴基酮)在鹼溶液中氧化,這樣直接就能得到α-羥基酸。因為在鹼性條件下,氧化生成的二酮會自行重排。例如將苯偶姻用溴酸鈉的鹼溶液處理,得到的就是二苯乙醇酸的鹽。
PhCOCHOHPh—→PhC(OH)—COONa(90%)反應條件:溴酸鈉的鹼溶液
環狀二酮也能發生這種重排,重排結果,環縮小一級。例如,
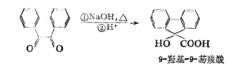 環狀二酮重排
環狀二酮重排套用示例
具有供電子基的芳環有利於重排,而具有吸電子基時則不利於重排。本重排反應是不可逆的。它主要適用於α-二芳酮,某些脂肪族、脂環族、雜環族的α-二酮以及α-二酮醛等亦可進行此重排。
 套用示例
套用示例該重排一般在強鹼(如NaOH,KOH)催化下進行。若以不含α-氫原子的烷氧基負離子(如MeO ,t-BuO )代替OH ,則直接生成酯。
