定義
單分子共軛鹼消除反應(E1cB反應,E代表消除Elimination,c代表共軛conjugate,B代表鹼,base)是消除反應的一種機理。
機理
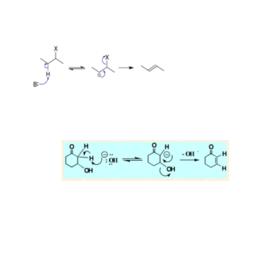
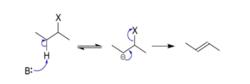
反應中,先由鹼奪取底物離去基團的β-氫生成碳負離子(共軛鹼),然後該共軛鹼的離去基團離開,生成烯烴。E1cb反應是反式共平面的消除反應。
 e1cb
e1cb 第一步反應為平衡反應,其速率較快,使底物很快與其共軛鹼形成平衡。
第二步為總反應的速率控制步驟,是較慢的一步。總反應的速率控制步驟只與一個分子有關,是單分子過程,因此稱為“E1”反應。但是與E1反應相比,此類反應中發生消除的不是底物分子,而是底物的共軛鹼,因此記為“E1cB反應”,全稱“單分子共軛鹼消除反應”。
具有以下特點的物質容易發生E1cB反應:
1)β-碳原子上連有強的吸電子基,從而使β氫具有較強的酸性,使碳負離子得以穩定。
2)離去基團難以離去。
舉例說明
醇的E1cB機制
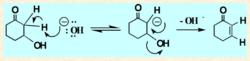 e1cb
e1cb 氟代烴的E1cB機制
氟代烴發生類似的E1cB反應,得到反zaitsev規則為主的烯烴;
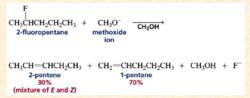 e1cb
e1cb 季銨鹼的E1cB機制
季銨鹼發生霍夫曼消除,也有類似的類似的E1cB反應,得到反zaitsev規則為主的烯烴;這種選擇性被稱為霍夫曼取向。
 e1cb
e1cb 知識擴展
單分子消除反應
單分子消除反應(E1反應,E代表 Elimination) 反應物先電離,離去基團斷裂下來,同時生成一個碳正離子,然後失去β氫原子並生成π 鍵。反應分兩步進行,決定速率這一步(決速步)只有反應物分子參加。故E1的速率與反應物的濃度成正比,與鹼的濃度無關。單分子消除反應,而1代表反應速率只受其中一個化合物濃度的影響),由於反應的速率控制步驟只與一個底物分子有關,是單分子過程,在反應動力學上是一級反應,故稱為“單分子消除反應”。
雙分子消除反應
雙分子消除反應(又名E2反應,E代表 Elimination,而2代表反應速率受到二個化合物濃度的影響),為消除反應的一項反應機構,由於反應為一步形成,與二種反應物濃度皆有關,在反應動力學上是屬於二級反應。鹼的強弱對其反應速率有很顯著的影響,越強的鹼能使反應進行越快,而對於離去基來說,E2反應需要好的離去基方能進行反應。